Credito:Wiley
Indoli, e strutture da esse derivate, sono un componente di molte sostanze naturali, come l'aminoacido triptofano. Una nuova reazione catalitica produce ciclopenta[ b ] indoli, strutture costituite da tre anelli uniti ai bordi, in modo molto selettivo e con la struttura spaziale desiderata. Come riporta un team di ricerca sulla rivista Angewandte Chemie , le velocità delle diverse fasi della reazione giocano un ruolo critico.
I derivati dell'indolo sono ampiamente distribuiti in natura; fanno parte della serotonina e della melatonina, così come molti alcaloidi, alcuni dei quali sono usati come droghe, Per esempio, come trattamenti per il morbo di Parkinson. L'indolo è un anello aromatico a sei membri fuso in un anello a cinque membri lungo un bordo. L'anello a cinque membri ha un doppio legame e un atomo di azoto. La struttura di base dell'indolo può essere dotata di una varietà di gruppi laterali o legata ad anelli aggiuntivi. L'indolo e molti derivati dell'indolo possono essere prodotti da una reazione di sintesi dell'indolo sviluppata da Emil Fischer (condensazione assistita da acido di chetoni con fenilidrazine).
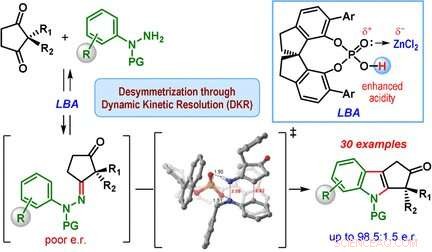
La classe più importante di derivati dell'indolo è il ciclopentano[ b ]indoli, molecole con una struttura costituita da un'unità indolica e da un anello aggiuntivo a cinque membri. Questo anello a cinque membri può contenere un centro di carbonio chirale, che è un anello in carbonio che ha due gruppi laterali aggiuntivi, e può essere organizzato in due modi che sono immagini speculari l'uno dell'altro. Solo uno dei due enantiomeri, o immagini speculari, si trova in natura. Però, la classica sintesi dell'indolo di Fischer produce un mix di entrambi gli enantiomeri.
Un team guidato da Santanu Mukherjee e Garima Jindal presso l'Indian Institute of Science, Bangalore (India) ha ora sviluppato una versione catalitica della sintesi dell'indolo di Fischer che produce principalmente uno degli enantiomeri (cioè, la reazione è enantioselettiva). I materiali di partenza sono una classe di dichetoni (2, ciclopentano-1 2-disostituito, 3-dioni) e derivati della fenilidrazina dotati di speciali gruppi protettivi. Il segreto del loro successo è un catalizzatore speciale:un chirale, acido fosforico ciclico. La reazione viene condotta in presenza di cloruro di zinco come co-catalizzatore e di una resina scambiatrice di cationi acida, che cattura l'ammoniaca che si forma come sottoprodotto.
Il cuore del meccanismo di reazione è chiamato risoluzione cinetica dinamica. Durante la reazione, un idrazone chirale viene prima formato come intermedio in entrambe le forme enantiomeriche. Questo passaggio è reversibile, in modo che entrambi gli idrazoni enantiomerici possano interconvertire nel corso della reazione. La reazione degli idrazoni per produrre i derivati dell'indolo è la vera reazione catalitica. Questa reazione è molto più veloce per uno degli enantiomeri idrazone rispetto all'altro perché una forma ha una geometria più favorevole quando si lega al catalizzatore chirale. L'altro enantiomero idrazone reagisce molto lentamente e porta solo a una piccola quantità del prodotto indolo. Anziché, l'enantiomero idrazone a reazione lenta si converte nell'enantiomero idrazone a reazione rapida, facendo sì che l'equilibrio alla fine si sposti al prodotto ciclopentano[ b ] indolo.
Questo metodo ha permesso al team di produrre molti diversi derivati dell'indolo con rese moderate, ma con selettività enantiomerica da buona a eccellente.