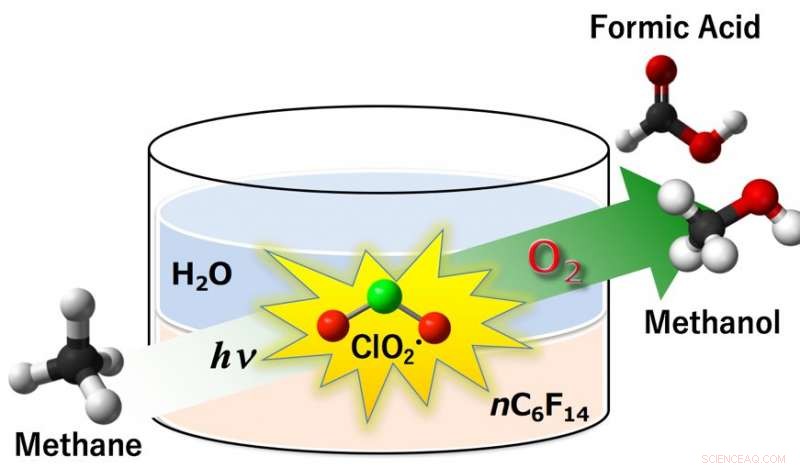
Fig.1:Il radicale di biossido di cloro (ClO2•) è risultato agire come un efficiente agente ossidante nell'ossigenazione aerobica del metano in metanolo e acido formico sotto fotoirradiazione. Le rese di metanolo e acido formico erano del 14% e dell'85%, rispettivamente, con una conversione di metano del 99% in condizioni ambientali (298 K, 1 atm) in un sistema a due fasi comprendente perfluoroesano e acqua. Credito:Università di Osaka
I radicali liberi non ottengono la stampa migliore. Però, mentre sono conosciuti come ossidanti nocivi nel corpo, queste sostanze chimiche ultra-reattive sono indispensabili in laboratorio. Le reazioni radicali svolgono un ruolo in tecnologie chiave come la rimozione degli inquinanti e la scissione dell'acqua.
Ora, ricercatori dell'Università di Osaka hanno usato i radicali per trasformare un gas serra, metano, in sostanze chimiche utili. Spinto dalla luce, questo processo rispettoso dell'ambiente raggiunge un obiettivo che è rimasto inafferrabile per decenni.
Il metano (CH4) è correlato al metanolo e all'acido formico, che sono necessari in grandi quantità dall'industria chimica. I batteri possono ossidare il CH4 in metanolo quasi senza sforzo usando enzimi naturali. La stessa trasformazione in laboratorio, però, richiede chimicamente ad alta temperatura, alta pressione e reagenti costosi per scindere i legami C—H estremamente forti. Come riportato di recente, il nuovo processo utilizza potenti radicali del cloro per attivare quei legami. Ciò consente alla reazione di avvenire a temperatura ambiente, sotto la luce della lampada, con ossigeno semplice come agente ossidante.
I radicali liberi sono sostanze chimiche con elettroni spaiati:la loro reattività dilagante deriva dall'urgente necessità che gli elettroni solitari trovino partner in un'altra molecola. Nel processo di Osaka, Il diossido di clorito (ClO2•) viene attivato sotto la fotoirradiazione per dare i radicali del cloro (Cl•) e l'ossigeno singoletto. Il radicale altamente reattivo, Cl•, quindi astrae un atomo di idrogeno di CH4 per dare radicali metilici, CH3•, che a loro volta reagiscono con l'ossigeno per produrre prezioso metanolo e acido formico. Questo processo apparentemente semplice, però, si basa su un sottile tocco di design.
"L'attivazione del metano da parte di specie radicali è stata provata in precedenza, " studio un autore principale Prof. Kei Ohkubo dice. "Tuttavia, Gli intermedi CH3• tendono a reagire con il solvente organico idrocarburico dando la disattivazione degli intermedi radicalici reattivi. Questo non si verifica in acqua, ma sfortunatamente il metano si dissolve a malapena in acqua." I ricercatori hanno trovato un modo accurato per aggirare questo:due solventi in un unico sistema, uno per ogni fase del processo. La formazione iniziale di ClO2• avviene in una fase acquosa, dove il clorito di sodio è solubile. Quindi, ClO2• si trasferisce a una fase di perfluoroesano (PFH), dove il metano e l'O2 si dissolvono per reagire con essi.
"PFH è l'ideale per il secondo passaggio:dissolve il metano, ma non reagisce con i radicali CH3•, " spiega Ohkubo. "Questo crea uno spazio per l'ossidazione di CH3•, dando i prodotti desiderati. Quindi, dopo che si sono formati metanolo e acido formico, attraversano il confine del solvente nella direzione opposta, nella fase acquosa. Qui sono protetti da un'ulteriore ossidazione in CO o CO2 indesiderata come gas serra".
Il processo completo è straordinariamente efficiente, convertire oltre il 99% del metano nei prodotti target, senza la necessità di alte temperature o pressioni.
"Questo è il primo uso riuscito dell'ossigeno nell'aria per ossidare il metano in condizioni ambientali, " Dice Ohkubo. "I metodi ad alta intensità energetica per la produzione chimica devono essere gradualmente eliminati:abbiamo urgente bisogno di soluzioni intelligenti per elaborare le materie prime in modo delicato, modo rispettoso dell'ambiente. Il nostro studio mostra come questo può essere fatto per il metano. Il concetto di solvente a due fasi, dove gli intermedi instabili sono protetti da un solvente come PFH, potrebbe essere potenzialmente esteso a tutta l'industria."