Credito:Dr. Masahiro Yamashina
molecole anfifiliche, che aggregano e incapsulano le molecole nell'acqua, trovano impiego in diversi campi della chimica. Il semplice, la connessione senza additivi di molecole idrofile e idrofobe sarebbe un metodo efficiente per la sintesi di molecole anfifiliche. Però, tali connessioni, o obbligazioni, sono spesso fragili in acqua. Ora, gli scienziati del Tokyo Institute of Technology hanno sviluppato un modo semplice per preparare anfifili stabili in acqua mediante una semplice miscelazione. Il loro nuovo metodo privo di catalizzatori e reagenti aiuterà a creare ulteriori materiali funzionali.
Saponi e detersivi sono usati per pulire cose come vestiti e piatti. Ma come funzionano concretamente? Si scopre che sono fatti di lunghe molecole contenenti una parte "idrofila" o amante dell'acqua e una parte "idrofoba" o che odia l'acqua. Quando aggiunto all'acqua, queste molecole si autoassemblano per formare giganti, "supramolecole" sferiche chiamate micelle che ottengono la pulizia effettuata utilizzando la parte idrofoba per intrappolare il grasso.
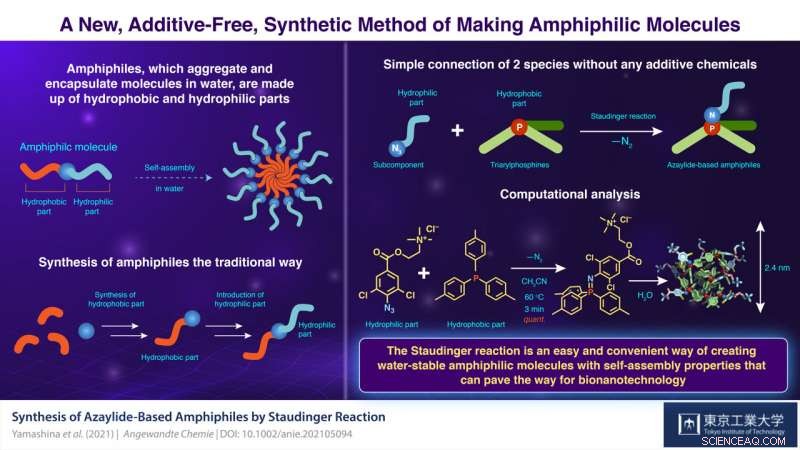
Conosciuti come "anfifili" dai chimici, queste molecole hanno attirato molta attenzione per la loro utilità nello sviluppo di materiali supramolecolari. La sintesi degli anfifili richiede solitamente diverse reazioni e purificazioni. In contrasto, se le molecole idrofile e idrofobe potessero essere semplicemente collegate senza prodotti chimici, sarebbe un metodo sintetico molto potente. Infatti, sono note oggi alcune reazioni che non richiedono catalizzatori o reagenti. Però, hanno un difetto fatale:i loro legami chimici sono instabili nell'acqua, il mezzo necessario per la formazione delle micelle!
Affrontare questo problema in un recente studio pubblicato su Angewandte Chemie , scienziati del Tokyo Institute of Technology (Tokyo Tech), Giappone, guidato dal Dr. Masahiro Yamashina e dal Prof. Shinji Toyota, ora hanno trovato una soluzione utilizzando una reazione chimica nota come "reazione di Staudinger, " in cui un'azide (parte idrofila) e una fosfina (parte idrofoba) si combinano per formare un "azaylide".
"Sebbene una tipica reazione di Staudinger proceda rapidamente e quantitativamente a temperatura ambiente, l'azaylide formatosi idrolizza facilmente in un'ammina primaria e un ossido di fosfina in acqua. In contrasto, è stata recentemente trovata una versione "non idrolitica" di questa reazione, in cui un atomo di alogeno, come il cloro, aggiunto a un composto azidico migliora significativamente l'idrostabilità dell'azaylide, " spiega Yamashina.
Di conseguenza, il team di scienziati ha preparato un sottocomponente di azide clorurata e lo ha miscelato con tris(p-tolil)fosfina (PTol 3 ), trifenilfosfina (PPh 3 ), e tris(p-anisil)fosfina (PAni 3 ) per ottenere gli anfifili a base di azaylide NPTol 3 , NPPh 3 , e NPAni 3 , rispettivamente. Hanno quindi sciolto gli anfifili in acqua per osservare il loro comportamento autoassemblante e hanno trovato in ogni caso un'aggregazione spontanea. Ulteriori misurazioni hanno rivelato che gli aggregati avevano la forma di sfere di circa 2 nm di dimensione.
Il team ha anche preparato i corrispondenti anfifili a base di azaylide non clorurati—nNPTol 3 , nNPph 3 , e nNPAni 3 —ed ha studiato la stabilità all'acqua degli azaylides clorurati e non clorurati. Gli azaylides non clorurati si sono disintegrati rapidamente in acqua mentre le loro controparti clorurate sono rimaste stabili. Mentre la differenza era chiaramente dovuta alla presenza dell'atomo di cloro, il meccanismo sottostante non era chiaro. Per capirlo, gli scienziati hanno eseguito calcoli della teoria del funzionale della densità che li hanno aiutati a comprendere le strutture degli azaylides.
Finalmente, quando testato con coloranti organici idrofobici come Nile Red e BODIPY, il team ha visto che le molecole di colorante sono state incapsulate dagli aggregati sferici di azaylide, esibendo un comportamento anfifilo desiderabile. "La formazione di azaylide presentata nel nostro studio serve come tecnica praticabile per la preparazione in loco di anfifili stabili all'acqua senza catalizzatori e reagenti, che può aiutare a creare più materiali così funzionali in futuro, " dice Yamashina.