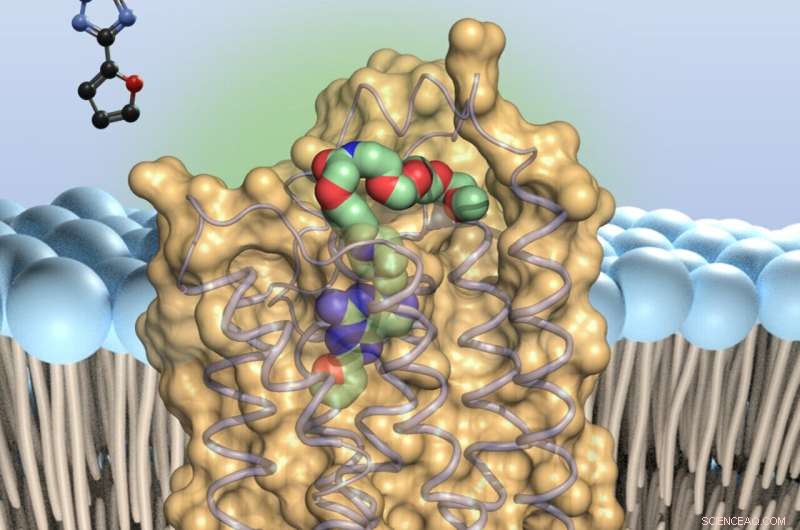
L'antagonista dell'adenosina (colorato) - si lega alle minuscole antenne sulla superficie delle cellule immunitarie, i recettori dell'adenosina di tipo 2A. Questo rallenta le truppe immunitarie. Credito:Università di Bonn
Il recettore A2A regola la forza con cui il sistema immunitario innato attacca le cellule malate. I ricercatori dell'Università di Bonn sono stati ora in grado di mostrare per la prima volta come un importante inibitore si leghi al recettore. In futuro, i risultati faciliteranno la ricerca mirata di molecole che diano più forza al sistema immunitario innato. Questi potrebbero ad esempio essere utilizzati nella lotta contro il cancro, ma anche contro malattie del cervello come l'Alzheimer o il morbo di Parkinson. La versione finale dello studio è stata pubblicata sulla rivista Angewandte Chemie International Edition .
Chiunque ami leggere i thriller lo sa:prima che i ladri facciano irruzione in una villa, gli piace lanciare una succosa braciola oltre il recinto, in cui hanno nascosto alcuni sonniferi. Quando i cani da guardia scendono per la loro seconda cena, soccombono a un sonno profondo poco dopo. I gioielli della padrona di casa passano di mano molto più imperterriti dopo.
Le cellule tumorali spesso procedono in modo molto simile:scacciano sonniferi che paralizzano il sistema immunitario. Più precisamente, si circondano di una nuvola di adenosina, importante messaggero endogeno. In questo modo, disabilitano le "cellule killer" del corpo, che altrimenti causerebbero la morte delle cellule tumorali.
Questo perché le molecole di adenosina si legano a minuscole antenne sulla superficie delle cellule immunitarie, i recettori A2A (l'abbreviazione sta per "recettori dell'adenosina di tipo 2A"). Questo mette fuori combattimento le truppe difensive, per così dire. I ricercatori di tutto il mondo sono quindi alla ricerca di molecole in grado di bloccare il recettore A2A e prevenire l'effetto paralizzante dell'adenosina.
Bombardamento con raggi X
"Il nostro studio dovrebbe rendere questa ricerca molto più semplice", spiega la prof.ssa Christa Müller dell'Istituto farmaceutico dell'Università di Bonn. "Abbiamo aggiunto nuove varianti di un inibitore noto, una sostanza chiamata preladenante, al recettore A2A. Quindi abbiamo creato cristalli dai complessi recettore-inibitore:è la prima volta al mondo che ciò è stato ottenuto con sostanze simili a precaricanti. "
La cristallizzazione ha permesso di chiarire la struttura del complesso. "Per fare questo, bombardiamo il composto con i raggi X", spiega Tobias Claff, che ha eseguito la parte principale degli esperimenti. "Il cristallo diffrange i raggi. Il modo in cui lo fa ci consente quindi di dedurre la struttura spaziale del complesso, fino alla disposizione dei singoli atomi e alle loro interazioni".
In questo modo, i ricercatori sono stati in grado di mostrare a quali punti si lega il precadenante del recettore A2A. Con questa conoscenza, è ora possibile modificare in modo specifico l'inibitore per conferirgli proprietà migliori. Oltre ad avere l'effetto più forte possibile, i farmaci, ad esempio, non dovrebbero essere scomposti troppo rapidamente. Devono anche essere in grado di raggiungere il luogo in cui dovrebbero svolgere il loro lavoro, in questo caso il cervello. "Il nostro studio renderà molto più facile ottimizzare la sostanza", afferma Claff con ottimismo.
L'A2A appartiene a un gruppo di recettori che regolano le funzioni chiave dell'organismo. Attraversano la membrana delle cellule. La parte di essi che si trova all'esterno della membrana funge da sensore, ricevendo segnali molecolari come un'antenna. Quando lo fa, innesca reazioni specifiche con la sua parte che sporge nella cellula. Questo poi attiva alcuni geni, per esempio.
Colorante legato alla molecola inibitoria
"Questi recettori sono immensamente importanti a causa della loro posizione centrale", afferma Christa Müller, che è anche membro delle aree di ricerca transdisciplinare (TRA) "Building Blocks of Matter" e "Life and Health". "Molti di essi, tuttavia, sono purtroppo relativamente instabili. Questo è sfavorevole per le analisi strutturali a raggi X:la cristallizzazione richiede giorni, a volte anche settimane". I ricercatori hanno quindi modificato in modo specifico il recettore A2A in un unico punto, rendendolo notevolmente più stabile.
Inoltre, sono riusciti ad attaccare un colorante al precaricante con una specie di filo molecolare. "Questo ci permette di controllare dove nel tessuto precaricante si attacca al recettore A2A", dice Müller. Allo stesso tempo, la lunghezza e la flessibilità della nanostring assicurano che l'inibitore non sia ostacolato dal legame con il recettore.
Entrambi i progressi potrebbero anche fungere da modelli per il lavoro con altri recettori che appartengono allo stesso gruppo. "I metodi che abbiamo sviluppato a Bonn negli ultimi anni ci permetteranno di chiarire la struttura di queste e di altre proteine della membrana cellulare in futuro", è convinto il farmacista. "Non ci sono molte strutture di ricerca in grado di eseguire questo tipo di analisi strutturale di molecole estremamente complesse". + Esplora ulteriormente