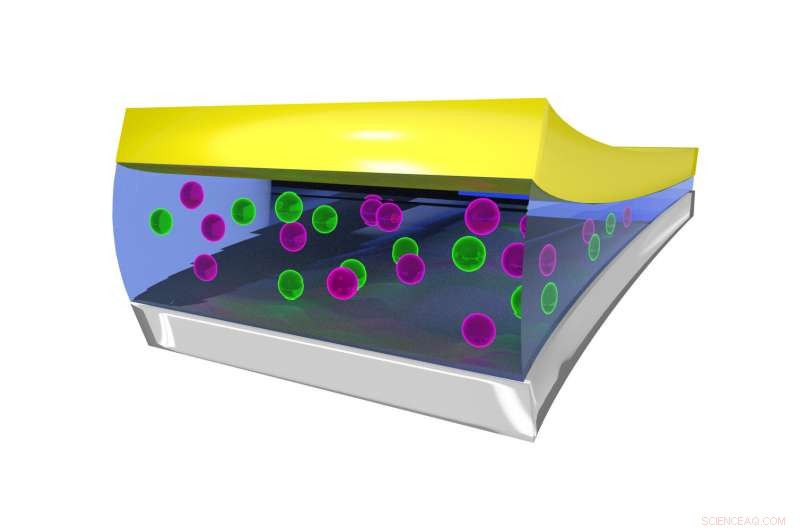
Fermo immagine che mostra l'ambiente di coordinazione dello ione F nell'elettrolita liquido, stabilizzato da molecole di BTFE. Credito:Dr. Brett Savoie – Caltech/Perdue
Immagina di non dover caricare il tuo telefono o laptop per settimane. Questo è il sogno dei ricercatori che cercano batterie alternative che vadano oltre le attuali versioni agli ioni di litio oggi popolari. Ora, in un nuovo studio apparso sulla rivista Scienza , chimici presso diversi istituti, tra cui Caltech e il Jet Propulsion Laboratory, che è gestito da Caltech per la NASA, così come l'Honda Research Institute e il Lawrence Berkeley National Laboratory, hanno scoperto un nuovo modo di produrre batterie ricaricabili a base di fluoro, la forma carica negativamente, o anione, dell'elemento fluoro.
"Le batterie al fluoro possono avere una maggiore densità di energia, il che significa che possono durare più a lungo, fino a otto volte più a lungo delle batterie in uso oggi, ", afferma il coautore dello studio Robert Grubbs, Victor ed Elizabeth Atkins del Caltech Professore di Chimica e vincitore del Premio Nobel 2005 per la Chimica. "Ma lavorare con il fluoro può essere difficile, in particolare perché è così corrosivo e reattivo."
Negli anni '70, i ricercatori hanno tentato di creare batterie al fluoro ricaricabili utilizzando componenti solidi, ma le batterie a stato solido funzionano solo ad alte temperature, rendendoli poco pratici per l'uso quotidiano. Nel nuovo studio, gli autori riferiscono di aver finalmente scoperto come far funzionare le batterie al fluoro utilizzando componenti liquidi e le batterie liquide funzionano facilmente a temperatura ambiente.
"Siamo ancora nelle prime fasi di sviluppo, ma questa è la prima batteria al fluoro ricaricabile che funziona a temperatura ambiente, "dice Simon Jones, un chimico del JPL e corrispondente autore del nuovo studio.
Le batterie guidano le correnti elettriche spostando atomi carichi, o ioni, tra un elettrodo positivo e uno negativo. Questo processo di spola procede più facilmente a temperatura ambiente quando sono coinvolti liquidi. Nel caso delle batterie agli ioni di litio, il litio viene trasportato tra gli elettrodi con l'aiuto di una soluzione liquida, o elettrolita.
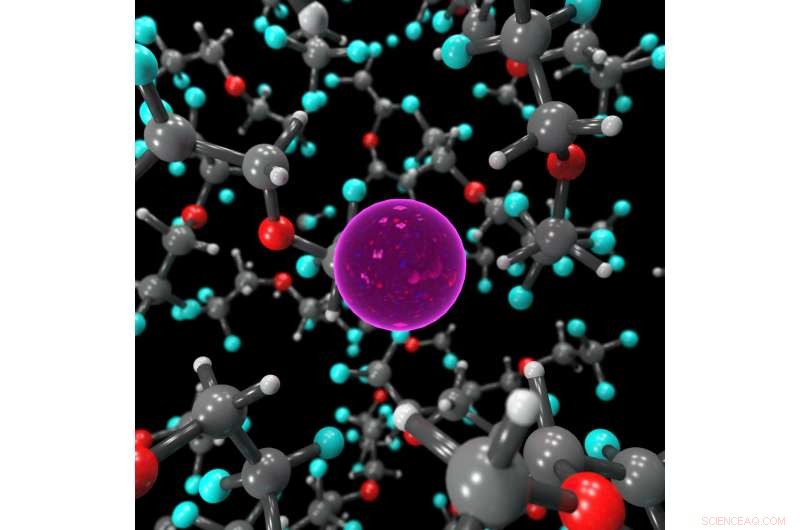
Fermo immagine che mostra l'ambiente di coordinazione dello ione F nell'elettrolita liquido, stabilizzato da molecole di BTFE. Credito:Dr. Brett Savoie – Caltech/Perdue
"Ricaricare una batteria è come spingere una palla su per una collina e poi lasciarla tornare indietro, ancora ed ancora, ", afferma il coautore Thomas Miller, professore di chimica al Caltech. "Vai avanti e indietro tra immagazzinare l'energia e usarla."
Mentre gli ioni di litio sono positivi (chiamati cationi), gli ioni fluoruro utilizzati nel nuovo studio hanno una carica negativa (e sono chiamati anioni). Ci sono sia sfide che vantaggi nel lavorare con gli anioni nelle batterie.
"Per una batteria che dura più a lungo, è necessario spostare un numero maggiore di cariche. Spostare cationi metallici a carica multipla è difficile, ma un risultato simile può essere ottenuto spostando diversi anioni caricati singolarmente, che viaggiano con relativa facilità, "dice Jones, che fa ricerca al JPL sulle fonti di energia necessarie per i veicoli spaziali. "Le sfide con questo schema stanno facendo funzionare il sistema a tensioni utilizzabili. In questo nuovo studio, dimostriamo che gli anioni sono davvero degni di attenzione nella scienza delle batterie poiché dimostriamo che il fluoruro può funzionare a tensioni sufficientemente elevate".
La chiave per far funzionare le batterie al fluoro allo stato liquido piuttosto che allo stato solido si è rivelata un liquido elettrolitico chiamato bis(2, 2, 2-trifluoroetil)etere, o BTFE. Questo solvente è ciò che aiuta a mantenere stabile lo ione fluoruro in modo che possa trasportare gli elettroni avanti e indietro nella batteria. Jones dice che il suo tirocinante all'epoca, Victoria Davis, che ora studia all'Università del North Carolina, Collina della Cappella, è stato il primo a pensare di provare BTFE. Sebbene Jones non avesse molte speranze che avrebbe successo, il team ha deciso di provarlo comunque ed è rimasto sorpreso dal fatto che funzionasse così bene.
A quel punto, Jones si è rivolto a Miller per chiedere aiuto per capire perché la soluzione funzionava. Miller e il suo gruppo hanno eseguito simulazioni al computer della reazione e hanno scoperto quali aspetti del BTFE stavano stabilizzando il fluoruro. Da li, il team è stato in grado di modificare la soluzione BTFE, modificandolo con additivi per migliorarne le prestazioni e la stabilità.
"Stiamo sbloccando un nuovo modo di realizzare batterie di lunga durata, "dice Jones. "Il fluoro sta tornando di moda nelle batterie".