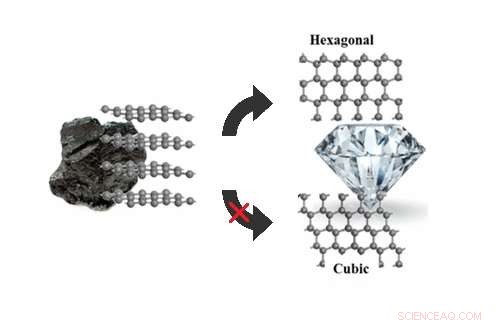
Le simulazioni stocastiche di camminata sulla superficie possono spiegare perché la grafite si trasforma in esagonale, non cubico, diamante sotto pressioni di 5-20 gigapascal. Credito:Xie et al. ©2017 American Chemical Society
(Phys.org)—I ricercatori hanno finalmente risposto a una domanda che è sfuggita agli scienziati per anni:quando esposti a pressioni moderatamente elevate, perché la grafite si trasforma in diamante esagonale (chiamato anche lonsdaleite) e non nel più familiare diamante cubico, come previsto dalla teoria?
La risposta si riduce in gran parte a una questione di velocità, o in termini di chimica, la cinetica di reazione. Utilizzando un nuovissimo tipo di simulazione, i ricercatori hanno identificato i percorsi a energia più bassa nella transizione da grafite a diamante e hanno scoperto che la transizione al diamante esagonale è circa 40 volte più veloce della transizione al diamante cubico. Anche quando il diamante cubico inizia a formarsi, una grande quantità di diamante esagonale è ancora mescolata.
I ricercatori, Yao-Ping Xie, Xiao Jie Zhang, e Zhi-Pan Liu alla Fudan University e alla Shanghai University di Shanghai, Cina, hanno pubblicato il loro studio sulle nuove simulazioni della transizione grafite-diamante in un recente numero del Giornale della Società Chimica Americana .
"Questo lavoro risolve il vecchio enigma del perché il diamante esagonale è prodotto preferibilmente dalla grafite anziché dal diamante cubico all'inizio della formazione del diamante, "Liu ha detto Phys.org . "Considerando che la grafite-diamante è un prototipo di transizione solido-solido, la conoscenza appresa da questo lavoro dovrebbe essere di grande beneficio per la comprensione della fisica e della chimica dei solidi ad alta pressione."
Grafite, diamante esagonale, e il diamante cubico sono tutti allotropi di carbonio, il che significa che sono fatti di atomi di carbonio che sono disposti in modi diversi. La grafite è costituita da strati sovrapposti di grafene, i cui atomi sono disposti in un reticolo a nido d'ape. Poiché gli atomi di carbonio nel grafene non sono completamente legati, il grafene è morbido e si sfalda facilmente, rendendolo ideale per l'uso come mina.
Entrambi i tipi di diamante, d'altra parte, sono costituiti da atomi di carbonio che hanno tutti il massimo di quattro legami, il che spiega perché il diamante è così duro. In diamante cubico (il tipo che si trova tipicamente in gioielleria), gli strati sono tutti orientati nella stessa direzione. In diamante esagonale, gli strati sono alternativamente orientati, dandogli una simmetria esagonale.
Sotto pressioni elevate di oltre 20 gigapascal (quasi 200, 000 volte la pressione atmosferica), teoria ed esperimento concordano sul fatto che la grafite si trasforma in diamante cubico, con qualche diamante esagonale mescolato. Ma sotto pressioni inferiori a 20 gigapascal, le simulazioni hanno sempre previsto che il diamante cubico dovrebbe essere il prodotto preferito, in contrasto con gli esperimenti.
Queste simulazioni si basano sulla previsione che, a queste pressioni, è necessaria meno energia per formare il nucleo cubico di nucleazione del diamante, o nucleo, il punto di partenza della crescita del diamante, piuttosto che formare il nucleo esagonale del diamante. Poiché la formazione di questo nucleo è la fase più dispendiosa in termini di energia dell'intero processo, ne consegue che la formazione del diamante cubico dovrebbe essere termodinamicamente più favorevole del diamante esagonale.
Ma uno dei principali svantaggi di queste simulazioni è che non tengono conto delle interfacce tra la grafite e i nuclei del diamante:un disallineamento del reticolo tra le due superfici può indurre un'energia di deformazione che può interferire con la stabilità del diamante in crescita.
Utilizzando una nuova simulazione chiamata camminata stocastica sulla superficie, i ricercatori del nuovo studio potrebbero esplorare più a fondo tutte le possibili interfacce e identificarne sette che corrispondono alle strutture intermedie a energia più bassa nella transizione da grafite a diamante.
Globale, i risultati mostrano che l'interfaccia tra grafite e nucleo di diamante esagonale è meno tesa e più stabile dell'interfaccia con il nucleo cubico di diamante. Tenere conto della stabilità di queste interfacce può finalmente spiegare perché il diamante esagonale si forma molto più facilmente e rapidamente del diamante cubico a pressioni moderate.
I ricercatori hanno aggiunto che, sebbene il diamante cubico possa sembrare più desiderabile del diamante esagonale per la persona media, entrambi i materiali hanno i loro vantaggi.
"Mentre il diamante cubico è familiare nella vita di tutti i giorni ed è un materiale molto utile, anche il diamante esagonale potrebbe essere molto utile, " Liu ha detto. "Per esempio, era previsto dalla teoria per essere ancora più duro del diamante cubico. Mentre il diamante esagonale (lonsdaleite) può essere trovato nei meteoriti, la produzione di grandi cristalli di diamante esagonale non è stata raggiunta nell'esperimento. Ci si aspetterebbe quindi che grandi cristalli di diamante esagonale, se prodotto, sarebbe ancora più prezioso del diamante cubico."
Nel futuro, i ricercatori stanno pianificando di migliorare ulteriormente le simulazioni incorporando tecniche da reti neurali e utilizzando big data.
© 2017 Phys.org