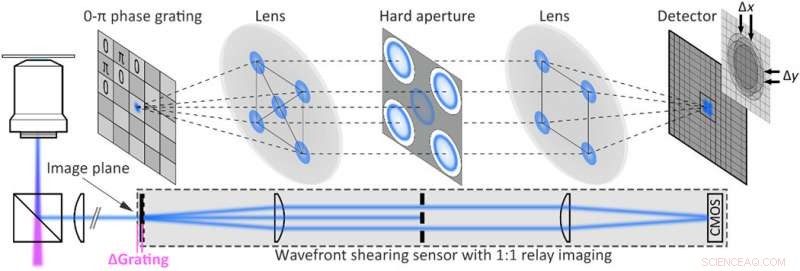
Implementazione sperimentale dell'olografia a fluorescenza single-shot. Configurazione dell'olografia a taglio di fluorescenza ottenuta estendendo un microscopio a fluorescenza widefield con un sensore di fronte d'onda composto da un reticolo di fase 0-π 2D e un sistema di imaging a relè montato sulla porta di uscita del microscopio. L'apertura rigida blocca tutti tranne i primi ordini di diffrazione. Credito:progressi scientifici, doi:10.1126/sciadv.abc2508
I biologi usano comunemente la microscopia a fluorescenza a causa della specificità molecolare e della super-risoluzione della tecnica. Però, il metodo è trattenuto dai limiti di imaging. In un nuovo rapporto su Progressi scientifici , Matz Liebel e un team di ricerca presso l'Istituto di scienza e tecnologia di Barcellona e il Massachusetts General Hospital in Spagna e negli Stati Uniti hanno riportato un approccio di imaging per recuperare l'intero campo elettrico della luce fluorescente utilizzando la sensibilità della singola molecola. Il team ha sperimentato il concetto di olografia digitale per il rilevamento rapido della fluorescenza tracciando la traiettoria tridimensionale (3D) delle singole nanoparticelle utilizzando una risoluzione nel piano di 15 nanometri. Come applicazioni biologiche proof-of-concept, i ricercatori hanno ripreso il movimento 3D delle vescicole extracellulari all'interno delle cellule vive.
Nano consegna nei tessuti viventi
In questo lavoro, Liebel et al. ha sviluppato la localizzazione di particelle 3-D basata sull'olografia di fluorescenza attraverso vescicole extracellulari all'interno di cellule vive e ha osservato vescicole fortemente confinate con periodi di trasporto attivo. La consegna del trasporto merci in vivo è attualmente una sfida significativa, al fine di implementare attivamente piattaforme di nanomedicina minimamente invasive. Le nanoparticelle (NP) e i veicoli extracellulari possono essere progettati come candidati promettenti da fornire come veicoli, ma gli scienziati non comprendono ancora il viaggio preciso di tali dispositivi nei tessuti viventi.
Per superare queste sfide, devono sviluppare metodi di imaging a particella singola tridimensionale (3D) ad ampio campo per tracciare le singole particelle contemporaneamente mentre viaggiano verso la destinazione prevista. I team di ricerca avevano precedentemente implementato approcci olografici alla microscopia, sebbene l'incoerenza della luce fluorescente non sia adatta per le cellule vive o per l'imaging di singole molecole. In confronto, l'interferometria di taglio è un metodo promettente per realizzare la registrazione a colpo singolo di processi dinamici. L'idea alla base dell'interferometria di taglio include l'auto-interferenza per accedere ai gradienti di fase fino a un singolo livello di fotone per ottenere l'olografia a fluorescenza a colpo singolo. I meccanismi sviluppati in questo lavoro servono quindi per osservare la traslocazione intracellulare su scale di lunghezza micrometrica per fornire ai biologi una visione più approfondita dei meccanismi intracellulari.

Flusso di lavoro per la ricostruzione del campo elettrico. (A) Immagine ottenuta sperimentalmente di perline fluorescenti da 200 nm sfocate che mostrano la modulazione spaziale indotta dal taglio delle funzioni di diffusione del punto (PSF). (B) La trasformazione rapida di Fourier (FFT) di (A) consente l'isolamento dei termini di interferenza di interesse sia nella dimensione x che nella dimensione y mediante isolamento dell'apertura rigida e spostamento a frequenza zero. (C) La trasformazione di Fourier veloce inversa (iFFT) dei termini isolati da (B) produce i gradienti di fase desiderati. (D) L'integrazione analitica 2D con un risolutore di Poisson produce l'immagine della fase grezza. (E) Scala di fase, per tenere conto della distanza tra il reticolo e il chip della fotocamera, seguita da risultati di correzione dell'aberrazione nella fase finale e nelle immagini di ampiezza. Tutte le barre della scala sono identiche, e l'avvolgimento di fase 0-2π è solo a scopo di visualizzazione; le informazioni scartate vengono ottenute direttamente. Credito:progressi scientifici, doi:10.1126/sciadv.abc2508
Principio di imaging e convalida del sistema per il tracciamento di particelle 3D
Il team ha utilizzato un microscopio a fluorescenza ad ampio campo con un sensore di taglio del fronte d'onda composto da un sistema di imaging a relè. La geometria del setup ha assicurato che fossero misurati gradienti di fase diversi da zero e ha permesso a Liebel et al. per eseguire l'autointerferenza di un singolo fotone su un'intera immagine. Il team ha ripreso le perle di polistirene fluorescente come particelle sfocate da 200 nm e ha estratto le informazioni sull'intensità come modulo di argomento delle immagini filtrate per l'estrazione del gradiente di fase. Dopo aver osservato l'intero campo elettrico, hanno usato l'ottica di Fourier per correggere complesse aberrazioni indotte dalla diffusione o costruire immagini su qualsiasi piano di scelta. Il team si è concentrato su esperimenti di localizzazione 3D che richiedono il recupero della posizione precisa di un emettitore di interesse in tutte le dimensioni, compreso il piano Z. Gli sforzi di focalizzazione computazionale hanno indicato la capacità precisa di determinare la posizione 3D di più particelle fluorescenti a diffusione libera.
Testare la traiettoria di messa a fuoco computazionale
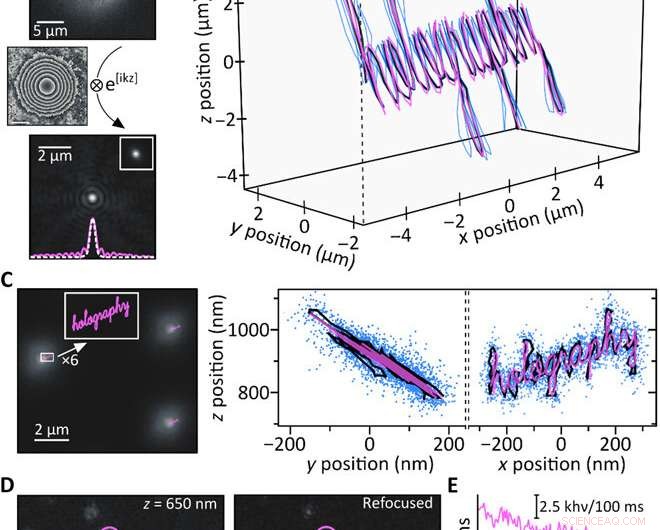
Esperimenti di prova di concetto. (A) Una perlina fluorescente da 200 nm registrata a 4,4 μm sopra il fuoco (in alto) viene rifocalizzata computazionalmente (in basso). L'inserto mostra un'immagine a fuoco ottenuta sperimentalmente della stessa particella accanto a un taglio attraverso le rispettive PSF (tratteggiato bianco:a fuoco; rosa, solido:riorientato). (B) Tracciamento 3D simultaneo di tre perline fluorescenti da 200 nm spostando il campione con uno stadio piezoelettrico lungo una traiettoria nota (rosa:movimento piezoelettrico; blu:traiettorie ricostruite di singole perline; nero:traiettoria media). Le singole traiettorie sono sovrapposte in x/y per chiarezza; z =0 μm corrisponde a una particella messa a fuoco. (C) Traiettorie piezoelettriche limitate alla sub-diffrazione (rosa) rispetto a un'immagine tipica ottenuta 900 nm sopra il fuoco (a sinistra). Le proiezioni della traiettoria media y/z e x/z risultanti (nero) concordano bene con la traiettoria piezoelettrica (rosa), e i punti blu mostrano tutte le posizioni ottenute tracciando simultaneamente 17 singole sfere fluorescenti (a destra). L'analisi basata sull'istogramma delle precisioni di localizzazione produce σx/σy =15 nm e σz =21,5 nm, rispettivamente (nota S7). (D) Le singole molecole ATTO647N registrate fuori fuoco (a sinistra) sono focalizzate con successo dal punto di vista computazionale (al centro). Le aree rappresentative dell'emissione di fluorescenza (rosa, viola, e blu) mostrano il photobleaching in una fase come previsto per i singoli emettitori. (E) Tracce temporali di fotodecolorazione delle tre regioni evidenziate in (D); la linea tratteggiata indica il livello di sfondo. Credito:progressi scientifici, doi:10.1126/sciadv.abc2508
Per testare il ragionamento computazionale dietro l'installazione, Liebel et al. ha generato una traiettoria 3D nota e spostato un campione contenente perline fluorescenti immobilizzate, mentre registrava le immagini lungo il percorso. Hanno recuperato le informazioni su fase e ampiezza e hanno determinato le posizioni 3D delle singole particelle utilizzando la propagazione numerica. Per quantificare l'intervallo Z accessibile, hanno sfocato sperimentalmente singole particelle e quindi riorientato computazionalmente le immagini per ottenere misurazioni prive di artefatti su un intervallo Z di circa otto µm. È importante garantire una localizzazione precisa su nanoscala su scale di lunghezza micrometrica in 3-D per diffondere particelle su nanoscala. L'olografia a fluorescenza ha soddisfatto questi requisiti. Come prova del concetto, gli scienziati hanno immaginato la parola "olografia, "dove ogni singola lettera di input misurava meno di 50 nm di larghezza per ottenere un output ben risolto, confermando la capacità di super risoluzione dell'olografia fluorescente.
Imaging di singole molecole e assorbimento cellulare di nanoparticelle
Il team ha mostrato come l'olografia a fluorescenza funzionasse in condizioni di super risoluzione biologicamente importanti misurando un campione composto da singole molecole. Nonostante le intensità di fluorescenza notevolmente ridotte nel setup sperimentale, il team ha ottenuto una messa a fuoco computazionale al limite di diffrazione anche per livelli di fotoni fino a 10 4 fotoni. Hanno visualizzato il traffico intracellulare di nanoparticelle inorganiche e vescicole extracellulari utilizzando il sistema. Come sistema modello, hanno usato nanobarre d'oro marcate con fluorescenza che sono inerti e quindi senza interferenze con le funzioni cellulari per accumularsi nel citoplasma, come verificato utilizzando immagini in campo oscuro di cellule vive. Il team ha seguito le traiettorie delle particelle registrando immagini di fluorescenza time-lapse ed ha estratto i termini di fase e ampiezza. Le funzioni di diffusione del punto (PSF) ampiamente variabili hanno indicato la presenza di nanobarre in diverse posizioni Z rispetto al piano focale.

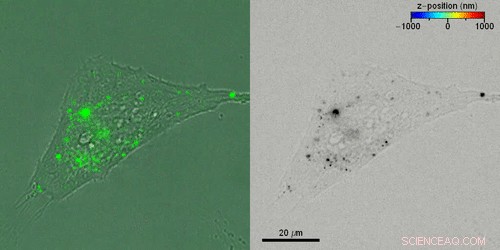
Tracciamento della fluorescenza 3D in cellule vive. (A) Tipico esperimento di tracciamento di una singola particella di cellule vive. (B) Immagini di fluorescenza satura (rosa) sovrapposte a corrispondenti immagini in campo chiaro di cellule renali di scimmia. (C) Ampiezza di fluorescenza (sinistra) e fase (destra) ottenute dal campione di cella di imaging B. Tutti i filmati sono registrati con un tempo di esposizione di 100 ms su un totale di 100 fotogrammi con un ciclo di imaging di 1/20 per consentire immagini. Per tenere conto delle grandi differenze di luminosità tra le particelle a fuoco e quelle fuori fuoco, mostriamo l'ampiezza normalizzata anziché l'intensità di fluorescenza e limitiamo la scala a 0,5 con il massimo a 1. Riquadri:originale, scartato, immagini di fase che mettono in evidenza la curvatura convessa/concava delle particelle sopra/sotto il piano focale dell'immagine. (D) Confronti di segmenti di immagine di ampiezza originale ottenuti da (C) con immagini ottenute mediante propagazione computazionale di -2 μm (in alto) e 2 μm (in basso). (E) Traiettorie 3D ottenute mediante olografia a fluorescenza per particelle che si diffondono all'interno di cellule vive. Ogni singola traiettoria ha una barra della scala individuale, e la posizione z è codificata a colori. Credito:progressi scientifici, doi:10.1126/sciadv.abc2508
Il team ha eseguito la localizzazione 3D di ogni singolo nanorod nella cellula e ha ricostruito le traiettorie delle particelle attraverso 100 frame di osservazione per ottenere sei categorie rappresentative, dove alcune particelle erano immobili durante i 200 secondi di tempo di osservazione, mentre altri si diffondono liberamente attraverso diversi micrometri. Le particelle rimanenti hanno mostrato sia lo stato legato che quello diffondente. In questo modo, il metodo di olografia a fluorescenza sottostante potrebbe determinare con precisione le posizioni 3D.
Captazione cellulare e trasporto attivo di vescicole extracellulari
Liebel et al. ha poi studiato il trasporto 3-D attivo di vescicole extracellulari (EV) all'interno di cellule vive incubando cellule HeLa con EV marcate in modo fluorescente. Hanno acquisito ologrammi fluorescenti ogni quattro secondi per ricostruire le traiettorie 3D dei singoli veicoli elettrici attraverso una combinazione di traiettorie automatizzate e manuali, collegando le posizioni EV 3-D. Liebel et al. proiezioni di ampiezza time-lapse sovrapposte di ologrammi fluorescenti con immagini in campo chiaro registrate simultaneamente di singole cellule, per mostrare come la maggior parte dei veicoli elettrici fosse localizzata ai margini delle cellule aderenti. Le osservazioni e i calcoli hanno suggerito che i veicoli elettrici erano intrappolati all'interno di un'area, confinare il loro movimento a un volume specifico; molto probabilmente appartenenti al citoscheletro cellulare.
Ricostruire le traiettorie 3D delle singole vescicole extracellulari (EV) all'interno delle cellule viventi. Credito:progressi scientifici, doi:10.1126/sciadv.abc2508
Veduta
In questo modo, Matz Liebel e colleghi hanno ideato un metodo di olografia a fluorescenza single-shot con ampio campo visivo per consentire il tracciamento 3-D di una singola particella su un intervallo Z di circa otto micrometri. Per dimostrare questo concetto, il team ha implementato una semplice configurazione sperimentale con un throughput di fotoni ottimizzato. Le caratteristiche ottimizzate hanno permesso all'olografia a fluorescenza di essere un approccio ideale per studiare il tracciamento delle particelle in tempo reale. Il team ha mostrato il tracciamento 3-D di una singola particella e ha osservato il movimento di oggetti su nanoscala nelle cellule vive, come nanobarre d'oro marcate con fluorescenza ed EV (vescicole extracellulari). Mentre i nanotubi d'oro si aggregavano solo nel citoplasma senza internalizzazione nel nucleo, gli EV si accumulavano ai bordi delle cellule aderenti in un effetto di affollamento. Liebel et al. aspettarsi di condurre una colorazione aggiuntiva per identificare il citoscheletro intracellulare, collegando così l'architettura intracellulare al movimento delle vescicole extracellulari. Questi sforzi faranno luce sui meccanismi precisi del trasporto del carico e dell'internalizzazione delle particelle all'interno delle cellule con importanti applicazioni in nanomedicina per rispondere a domande critiche in biologia e medicina. Il meccanismo è ugualmente adatto per condurre altri metodi di imaging volumetrico per tracciare i tessuti all'interno e per l'imaging biochimico del calcio.
© 2020 Scienza X Rete