
I ricercatori dell'Università di Tokyo hanno trovato un modo per migliorare la sensibilità dell'imaging di fase quantitativa esistente in modo che tutte le strutture all'interno delle cellule viventi possano essere viste contemporaneamente, da minuscole particelle a grandi strutture. Questa rappresentazione artistica della tecnica mostra impulsi di luce scolpita (verde, in alto) viaggiando attraverso una cella (al centro), e l'uscita (in basso) dove i cambiamenti nelle onde luminose possono essere analizzati e convertiti in un'immagine più dettagliata. Credito:s-graphics.co.jp, CC BY-NC-ND
Gli esperti di fisica ottica hanno sviluppato un nuovo modo di vedere all'interno delle cellule viventi in modo più dettagliato utilizzando la tecnologia di microscopia esistente e senza la necessità di aggiungere macchie o coloranti fluorescenti.
Poiché le singole cellule sono quasi traslucide, le fotocamere dei microscopi devono rilevare differenze estremamente sottili nella luce che passa attraverso parti della cellula. Queste differenze sono note come fase della luce. I sensori di immagine della fotocamera sono limitati dalla quantità di differenza di fase della luce che possono rilevare, detto intervallo dinamico.
"Per vedere maggiori dettagli utilizzando lo stesso sensore di immagine, dobbiamo espandere la gamma dinamica in modo da poter rilevare piccoli cambiamenti di fase della luce, ", ha affermato il professore associato Takuro Ideguchi dell'Istituto per la scienza e la tecnologia dei fotoni dell'Università di Tokyo.
Il team di ricerca ha sviluppato una tecnica per eseguire due esposizioni per misurare separatamente grandi e piccoli cambiamenti nella fase della luce e quindi collegarli perfettamente per creare un'immagine finale altamente dettagliata. Hanno chiamato il loro metodo Adaptive Dynamic Range Shift Quantitative Phase Imaging (ADRIFT-QPI) e recentemente hanno pubblicato i loro risultati in Luce:scienza e applicazioni .
"Il nostro metodo ADRIFT-QPI non necessita di laser speciali, nessun microscopio speciale o sensori di immagine; possiamo usare cellule vive, non abbiamo bisogno di macchie o fluorescenza, e ci sono pochissime possibilità di fototossicità, " disse Ideguchi.
La fototossicità si riferisce all'uccisione delle cellule con la luce, che può diventare un problema con alcune altre tecniche di imaging, come l'imaging a fluorescenza.
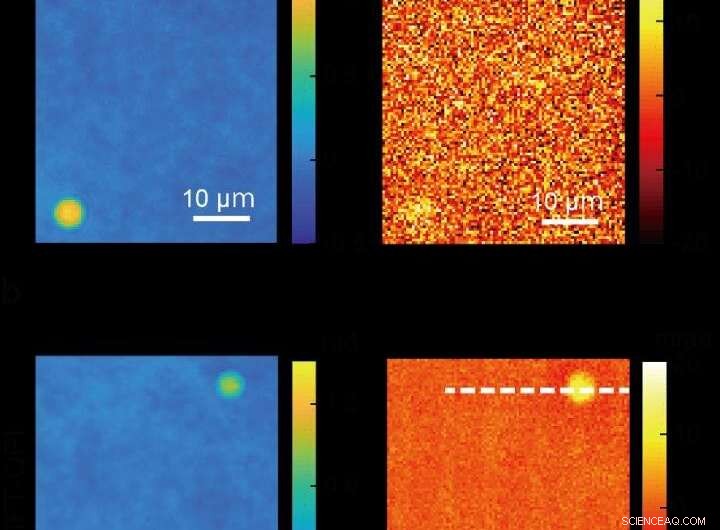
Immagini di perle di silice scattate utilizzando l'imaging di fase quantitativa convenzionale (in alto) e un'immagine più chiara prodotta utilizzando un nuovo metodo di microscopia ADRIFT-QPI (in basso) sviluppato da un team di ricerca dell'Università di Tokyo. Le foto a sinistra sono immagini della fase ottica e le immagini a destra mostrano il cambiamento di fase ottica dovuto all'assorbimento della luce nel medio infrarosso (molecolare specifico) da parte delle perle di silice. In questa dimostrazione dimostrativa, i ricercatori hanno calcolato di aver raggiunto una sensibilità circa 7 volte maggiore di ADRIFT-QPI rispetto a quella del QPI convenzionale. Credito:Toda et al., CC-BY 4.0
L'imaging di fase quantitativa invia un impulso di un foglio piatto di luce verso la cellula, quindi misura lo sfasamento delle onde luminose dopo aver attraversato la cellula. L'analisi computerizzata ricostruisce quindi un'immagine delle principali strutture all'interno della cellula. Ideguchi e i suoi collaboratori hanno già sperimentato altri metodi per migliorare la microscopia di fase quantitativa.
L'imaging quantitativo di fase è un potente strumento per l'esame di singole cellule perché consente ai ricercatori di effettuare misurazioni dettagliate, come monitorare il tasso di crescita di una cellula in base allo spostamento delle onde luminose. Però, l'aspetto quantitativo della tecnica ha una bassa sensibilità a causa della bassa capacità di saturazione del sensore di immagine, quindi tracciare particelle nanometriche dentro e intorno alle cellule non è possibile con un approccio convenzionale.
Il nuovo metodo ADRIFT-QPI ha superato la limitazione della gamma dinamica dell'imaging di fase quantitativa. Durante ADRIFT-QPI, la fotocamera esegue due esposizioni e produce un'immagine finale che ha una sensibilità sette volte maggiore rispetto alle tradizionali immagini di microscopia di fase quantitativa.
La prima esposizione viene prodotta con l'imaging di fase quantitativa convenzionale:un foglio piatto di luce viene impulsato verso il campione e gli sfasamenti della luce vengono misurati dopo che è passata attraverso il campione. Un programma di analisi dell'immagine del computer sviluppa un'immagine del campione in base alla prima esposizione, quindi progetta rapidamente un fronte d'onda di luce scolpito che rispecchia quell'immagine del campione. Un componente separato chiamato dispositivo di modellazione del fronte d'onda genera quindi questa "scultura di luce" con una luce di maggiore intensità per un'illuminazione più forte e la invia a impulsi verso il campione per una seconda esposizione.
Se la prima esposizione ha prodotto un'immagine che era una perfetta rappresentazione del campione, le onde luminose scolpite su misura della seconda esposizione sarebbero entrate nel campione in fasi diverse, passare attraverso il campione, poi emerge come un piatto foglio di luce, facendo in modo che la fotocamera non veda altro che un'immagine scura.
"Questa è la cosa interessante:cancelliamo l'immagine del campione. Non vogliamo vedere quasi nulla. Cancelliamo le strutture grandi in modo da poter vedere quelle più piccole con grande dettaglio, " ha spiegato Ideguchi.
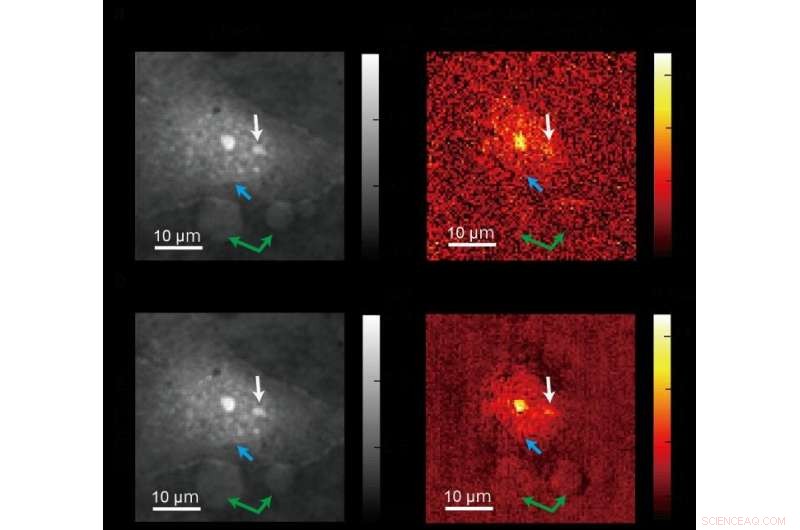
Un'immagine standard (in alto) scattata utilizzando l'imaging di fase quantitativa convenzionale e un'immagine più chiara (in basso) prodotta utilizzando un nuovo metodo di microscopia ADRIFT-QPI sviluppato da un team di ricerca dell'Università di Tokyo. Le foto a sinistra sono immagini della fase ottica e le immagini a destra mostrano il cambiamento di fase ottica dovuto all'assorbimento della luce nel medio infrarosso (molecolare specifico) principalmente da parte delle proteine. La freccia blu punta verso il bordo del nucleo, la freccia bianca punta verso i nucleoli (una sottostruttura all'interno del nucleo), e le frecce verdi puntano verso altre particelle di grandi dimensioni. Credito:Toda et al., CC-BY 4.0
In realtà, la prima esposizione è imperfetta, così le onde luminose scolpite emergono con sottili deviazioni di fase.
La seconda esposizione rivela piccole differenze di fase della luce che sono state "sbiadite" da differenze più grandi nella prima esposizione. Questa minuscola differenza di fase della luce residua può essere misurata con una maggiore sensibilità a causa dell'illuminazione più forte utilizzata nella seconda esposizione.
L'analisi computerizzata aggiuntiva ricostruisce un'immagine finale del campione con un intervallo dinamico ampliato dai due risultati di misurazione. Nelle dimostrazioni proof-of-concept, i ricercatori stimano che ADRIFT-QPI produce immagini con una sensibilità sette volte maggiore rispetto all'imaging di fase quantitativa convenzionale.
Ideguchi afferma che il vero vantaggio di ADRIFT-QPI è la sua capacità di vedere minuscole particelle nel contesto dell'intera cellula vivente senza bisogno di etichette o macchie.
"Per esempio, potrebbero essere rilevati piccoli segnali da particelle su scala nanometrica come virus o particelle che si muovono all'interno e all'esterno di una cellula, che consente l'osservazione simultanea del loro comportamento e dello stato della cellula, " disse Ideguchi.