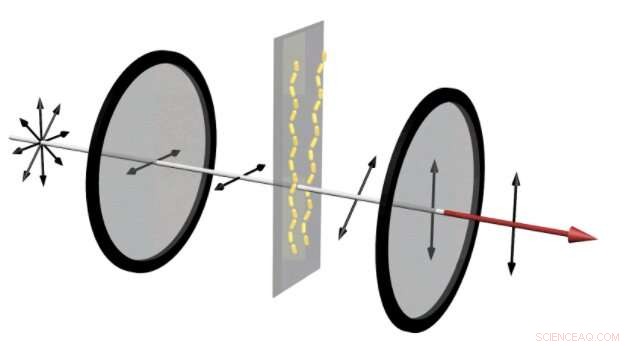
In un dispositivo che può rivelare se le proteine amiloidi si stanno assemblando in catene, la luce non polarizzata entra in un polarizzatore orizzontale. Ciò consente solo il passaggio delle onde che oscillano nella direzione orizzontale. Quindi, se le proteine amiloidi hanno assemblato i nanotubi d'oro in catene, la luce rossa viene distorta, cambiando l'angolo della sua polarizzazione. Quindi, quando passa attraverso il polarizzatore verticale, passa la porzione di luce che oscilla in direzione verticale. Ciò si traduce in un forte segnale rosso che può essere visto ad occhio nudo. Credito:Jun Lu, Università di Jilin e Università del Michigan
Un nuovo approccio crea segnali simili a cristalli liquidi con proteine amiloidi dannose presenti in malattie come il diabete di tipo II.
In una nuova tecnica di screening dei farmaci che si basa su nanobarre d'oro per distorcere la luce, un bagliore rosso può segnalare il fallimento di un farmaco progettato per trattare malattie "amiloidi" come il diabete di tipo II e il cancro del pancreas.
La tecnica è stata sviluppata da ricercatori dell'Università del Michigan, Università di Jilin in Cina, e l'Università Federale di São Carlos in Brasile. Sfrutta una proprietà chiamata "chiralità, " che si trova nelle nanostrutture, molecole biologiche come le proteine, e onde luminose. Un oggetto chirale non può essere sovrapposto alla sua immagine speculare, come una mano sinistra e destra, o eliche che si attorcigliano in direzioni diverse.
I ricercatori sono stati in grado di sfruttare la chiralità di un marker proteico per queste malattie, chiamati polipeptidi amiloidi delle isole. Queste proteine si legano in catene attorcigliate e si accumulano nei tessuti. Anche le proteine amiloidi che formano le fibre a forma di cavatappi svolgono un ruolo nelle malattie di Parkinson e di Huntington.
Nel nuovo approccio, nanotubi d'oro sono rivestiti con le proteine nocive, che formano lunghe fibre a forma di molla con tre nanobarre per giro. Queste strutture appaiono di un rosso brillante se osservate tra due polarizzatori ad angolo opposto, o filtri di luce, perché la loro torsione, le forme chirali possono trasformare la polarizzazione della luce.
"La forte torsione della luce consente di vedere i risultati dello screening farmacologico ad occhio nudo, invece di usare strumenti complicati, " ha detto Kun Liu, un professore di chimica presso l'Università di Jilin e co-autore corrispondente su un articolo appena pubblicato in Scienza .

Nel dispositivo a sinistra, nanobarre d'oro consentono una piccola quantità di luce attraverso i due polarizzatori incrociati. Questo è simile al segnale che mostra che un farmaco progettato per prevenire la formazione di placche amiloidi sta funzionando. Però, quando le proteine amiloidi assemblano i nanotubi d'oro in eliche, una chiara luce rossa è visibile attraverso i polarizzatori, rivelando che un farmaco ha fallito. Credito:Jun Lu, Università di Jilin e Università del Michigan
I nanorod, ciascuno lungo circa 50 nanometri e largo 20 nanometri, offrono ulteriori vantaggi.
"Le catene elicoidali periodiche aumentano la torsione della luce di 4, 600 volte, che li rende visibili in condizioni biologiche molto difficili. E i nanorod accelerano anche il processo di formazione delle catene amiloidi, che è fondamentale per la rapida scoperta di farmaci, " ha detto Nicholas Kotov, co-autore dell'articolo e professore di scienze chimiche e ingegneria alla Irving Langmuir Distinguished University presso la U-M.
Tipicamente, i polipeptidi amiloidi impiegano da pochi giorni a una settimana per collegarsi. Questo rallenta la sperimentazione di potenziali farmaci. I nanorod accelerano il processo dei polipeptidi amiloidi fino a un giorno. Ciò si verifica perché le aste sono rivestite con un tensioattivo chimico chiamato bromuro di cetrimonio, simile al cloruro di cetrimonio che si trova in alcuni shampoo e balsami. Quando le proteine amiloidi si legano alla canna dell'asta d'oro, il tensioattivo li aiuta a formare una forma a spirale che facilita il legame con altri amiloidi.
Quando gli amiloidi si connettono, le loro verghe d'oro formano un'elica, attorcigliando la corda proteica. E poiché l'oro interagisce fortemente con la luce rossa, queste eliche altamente organizzate torcono molto fortemente le onde di luce rossa.
Questo è ciò che porta alla facile individuazione se un farmaco per prevenire le catene amiloidi ha funzionato o meno. L'allestimento mette la realistica miscela di celle, componenti del sangue, molecole di farmaci e proteine amiloidi che i farmaci incontrano nel corpo tra due polarizzatori. Il primo polarizzatore lascia passare la luce solo se oscilla in direzione verticale. Il secondo polarizzatore fa passare solo le onde luminose che si muovono in direzione orizzontale.
Se la luce non si attorciglia tra i due polarizzatori, i due polarizzatori bloccano completamente la luce. Ecco cosa succede quando un farmaco ha successo:non si formano catene amiloidi, quindi solo pochi nanorod casuali stanno torcendo la luce. Pochissima luce passa attraverso i due polarizzatori. Però, se quelle catene si formano, torcono la luce rossa. Un bagliore rosso diventa chiaramente visibile, mostrando che il farmaco ha fallito.
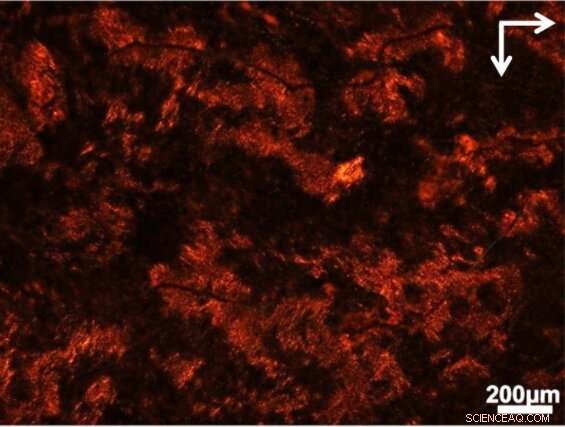
La vista attraverso il polarizzatore mostra dove si sono formate le strutture che attorcigliano la luce in un brodo di cellule e materiali biologici. Credito:Jun Lu, Università di Jilin e Università del Michigan
"Mentre gli esperimenti hanno messo a punto le condizioni migliori per rilevare le catene amiloidi, le simulazioni al computer sono state fondamentali per svelare le complesse interazioni tra oro, tensioattivi e frammenti proteici, che necessitano di interagire contemporaneamente per far funzionare la piattaforma, " disse André de Moura, un professore presso l'Università Federale di São Carlos e coautore del documento.
Il team internazionale ha anche stabilito principi di progettazione unificanti su come realizzare nanostrutture contorte che possono distorcere in modo significativo la luce, una caratteristica fondamentale per molte applicazioni.
L'opera rappresenta un viaggio di sette anni per Jun Lu, ora ricercatore in ingegneria chimica presso la U-M. All'inizio del suo dottorato di ricerca. sotto Liu in Cina, Lu ha iniziato cercando di convincere i polipeptidi amiloidi delle isole umane ad autoassemblarsi, con aste d'oro attaccate. Dopo circa un anno, lui e Liu avevano trovato segni deboli che le assemblee stavano torcendo la luce. Dopo un incontro fortuito in aeroporto con Kotov, il team ha iniziato a lavorare sul meccanismo delle interazioni luminose e sugli usi farmaceutici di questi assemblaggi.
Lu ha lavorato per rendere l'effetto più grande, dimensionamento delle nanobarre per completare la distanza tra le nanobarre. Il team internazionale ha esplorato l'applicazione di screening dei farmaci, e Lu hanno sviluppato simulazioni utilizzando il potente supercomputer Great Lakes presso l'Università del Michigan, mentre il suo collaboratore presso l'Università di San Paolo in Brasile, Kalil Bernardino, ha utilizzato il supercomputer SDumont per confermare i meccanismi alla base delle misurazioni sperimentali.
Sebbene il progetto fosse lungo, Lu dice, "Ogni sforzo è ben ricompensato. È proprio come un sogno che diventa realtà".
L'articolo è intitolato "Miglioramento dell'asimmetria ottica negli assiemi chiroplasmonici supramolecolari con ordine a lungo raggio, " e sarà pubblicato online dalla rivista Scienza di giovedì, 25 febbraio 2021.