Astratto grafico. Credito:DOI:10.1016/j.cplet.2021.138812
Nel 2017, Jacques Dubochet, Gioacchino Frank, e Richard Henderson hanno vinto il Premio Nobel per la Chimica per i loro contributi alla microscopia crioelettronica (cryoEM), una tecnica di imaging in grado di catturare immagini di biomolecole come le proteine con precisione atomica.
In cryoEM, i campioni sono immersi in ghiaccio vitreo, una forma di ghiaccio simile al vetro che si ottiene quando l'acqua viene congelata così rapidamente che non può verificarsi la cristallizzazione. Con il campione vetrificato, immagini ad alta risoluzione della loro struttura molecolare possono essere prese con un microscopio elettronico, uno strumento che forma immagini utilizzando un fascio di elettroni invece della luce.
CryoEM ha aperto nuove dimensioni nelle scienze della vita, chimica, e medicina. Per esempio, è stato recentemente utilizzato per mappare la struttura della proteina spike SARS-CoV-2, che è l'obiettivo di molti dei vaccini COVID-19.
Le proteine cambiano costantemente la loro struttura 3D nella cellula. Questi riarrangiamenti conformazionali sono parte integrante delle proteine per svolgere le loro funzioni specializzate, e avvengono entro milionesimi o millesimi di secondo. Tali movimenti veloci sono troppo veloci per essere osservati in tempo reale dagli attuali protocolli cryoEM, rendendo incompleta la nostra comprensione delle proteine.
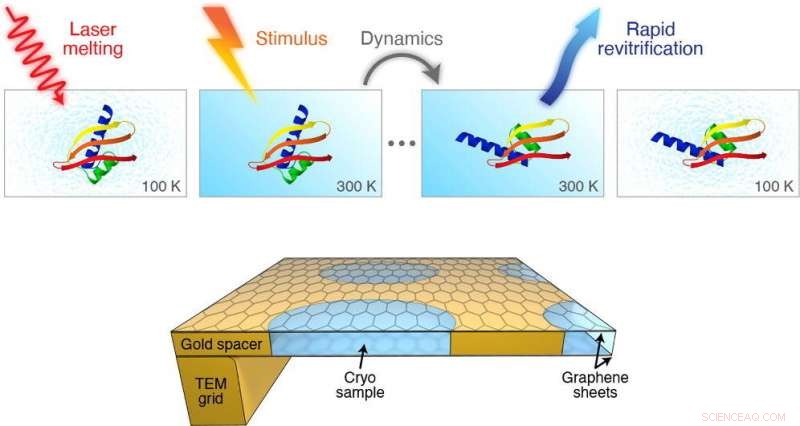
Ma un team di scienziati guidati da Ulrich Lorenz presso la School of Basic Sciences dell'EPFL ha sviluppato un metodo cryoEM in grado di catturare immagini dei movimenti delle proteine nella scala temporale di un microsecondo (un milionesimo di secondo). Il lavoro è pubblicato su Chemical Physics Letters.
Il metodo prevede la rapida fusione del campione vetrificato con un impulso laser. Quando il ghiaccio si scioglie in un liquido, c'è una finestra temporale sintonizzabile in cui la proteina può essere indotta a muoversi come fanno nel loro stato liquido naturale nella cellula.