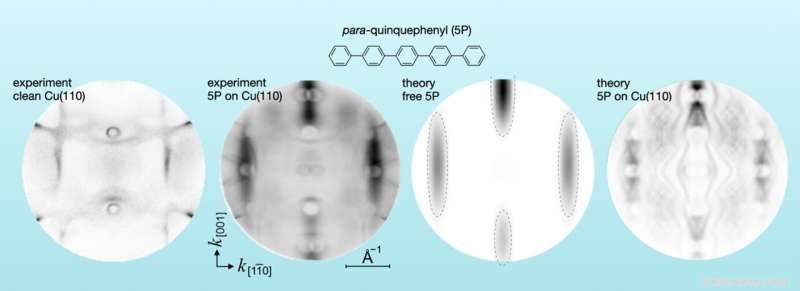
La distribuzione sperimentale della quantità di moto di fotoelettroni da rame puro e da molecole di para-quinquefenile adsorbite su rame (a sinistra) e la distribuzione teorica della quantità di moto da molecole libere e molecole adsorbite su rame (a destra). Credito:Forschungszentrum Jülich / X.Yang, S. Soubatch; Università di Graz / P. Puschnig
Cigolanti, torbidi o sferici:gli orbitali elettronici mostrano dove e come si muovono gli elettroni attorno ai nuclei e alle molecole degli atomi. Nella chimica e nella fisica moderne, hanno dimostrato di essere un modello utile per la descrizione della meccanica quantistica e la previsione delle reazioni chimiche. Solo se gli orbitali combaciano nello spazio e nell'energia possono essere combinati:questo è ciò che accade quando due sostanze reagiscono chimicamente tra loro. Inoltre, c'è un'altra condizione che deve essere soddisfatta, come hanno scoperto i ricercatori del Forschungszentrum Jülich e dell'Università di Graz:il corso delle reazioni chimiche sembra anche dipendere dalla distribuzione orbitale nello spazio della quantità di moto. I risultati sono stati pubblicati sulla rivista Nature Communications .
Le reazioni chimiche in definitiva non sono altro che la formazione e la rottura di legami elettronici, che possono anche essere descritti come orbitali. La cosiddetta teoria dell'orbitale molecolare consente quindi di prevedere il percorso delle reazioni chimiche. I chimici Kenichi Fukui e Roald Hoffmann hanno ricevuto il Premio Nobel nel 1981 per aver notevolmente semplificato il metodo, che ha portato alla sua diffusione e applicazione.
"Di solito, l'energia e la posizione degli elettroni vengono analizzate. Tuttavia, utilizzando il metodo della tomografia a fotoemissione, abbiamo esaminato la distribuzione della quantità di moto degli orbitali", spiega il dott. Serguei Soubatch. Insieme ai suoi colleghi del Peter Grünberg Institute (PGI-3) di Jülich e dell'Università di Graz in Austria, ha adsorbito vari tipi di molecole su superfici metalliche in una serie di esperimenti e ha mappato la quantità di moto misurata nel cosiddetto spazio della quantità di moto .
"La fotoemissione di molte molecole diverse sui metalli che misuriamo può anche essere prevista teoricamente. Come modello, si usa semplicemente la molecola libera che non interagisce con il metallo. Ma quando abbiamo misurato gli oligofenili sul rame, ci siamo improvvisamente resi conto che il risultato sperimentale differivano in modo significativo dalle previsioni teoriche. Alcune parti dello spazio di quantità di moto sono rimaste non occupate", ha detto Soubatch. Queste regioni di quantità di moto corrispondono ai gap di banda noti degli stati elettronici che si verificano tipicamente nei metalli nobili. E anche uno dei materiali coinvolti, il rame, è un metallo così nobile.
Per il lavoro, i ricercatori hanno condotto esperimenti presso l'Elettra Synchrotron a Trieste, in Italia. Lì, un consorzio internazionale guidato da Forschungszentrum Jülich gestisce lo spettroscopio NanoESCA su una linea di fascio, che contiene un microscopio elettronico a fotoemissione per misurazioni tomografiche orbitali. Il lavoro è stato svolto in collaborazione con il Prof. Michael. G. Ramsey e il teorico Prof. Peter Puschnig dell'Università di Graz. Con le sue simulazioni di meccanica quantistica per l'intero sistema di interazione, molecole e superficie metallica, Peter Puschnig ha fornito la chiave per spiegare il criterio di selezione appena scoperto. + Esplora ulteriormente