
Questa micrografia elettronica a trasmissione mostra un nanoporo allo stato solido:il cerchio bianco al centro dell'immagine. La struttura altrimenti a chiazze risulta dalla natura policristallina di una pellicola d'oro che è stata evaporata sulla membrana di nitruro di silicio (che non può essere vista). Credito:gruppo di Rant, TU MuenchenCopyright TU Muenchen
Un nuovo tipo di sensore, basato su pori su scala nanometrica in una membrana semiconduttrice, è un passo più vicino all'uso pratico in applicazioni come l'analisi del contenuto proteico di una singola cellula. I ricercatori pionieri della tecnologia dei sensori a nanopori a molecola singola presso la Technische Universität München (TUM) hanno mostrato il suo potenziale attraverso una serie di esperimenti negli ultimi anni. Ora, in collaborazione con i biochimici della Goethe University di Francoforte, sono stati in grado di portare avanti questo sforzo oltre quello che era stato un punto critico:migliorare la selettività del sensore mantenendo la sua sensibilità alle singole molecole. Riportano gli ultimi risultati in Nanotecnologia della natura .
La ricerca volta a fabbricare e controllare dispositivi diagnostici sulla scala delle molecole biologiche è avanzata al punto che diversi approcci diversi sono visti come competitivi per l'applicazione pratica in un futuro relativamente prossimo. La ricerca non è creare un universale, sensore ad ampio spettro, ma piuttosto una tecnologia per rilevare e identificare singole molecole di proteine specificamente mirate, senza la necessità di modificarle aggiungendo "etichette" biochimiche. Tale tecnologia potrebbe essere utilizzata, Per esempio, accelerare la traduzione delle intuizioni dalla genomica alla conoscenza pratica della proteomica. Questo è di vitale interesse per la ricerca medica e farmaceutica, nonché per studi biologici più fondamentali. Un'altra potenziale applicazione spesso citata è il rilevamento di agenti di guerra biologica.
Uno degli approcci più promettenti si basa sull'ingegnerizzazione di un "checkpoint" molecolare, " un passaggio monitorato tra due soluzioni saline separate da una membrana artificiale. Questo cosiddetto nanoporo è dimensionato e modellato in modo che le molecole debbano attraversarlo una alla volta. La presenza di una molecola nel percorso produce cambiamenti misurabili nella conduttività elettrica attraverso il nanoporo, e ulteriori perfezionamenti possono mettere a punto tale rivelatore per renderlo un "controllo di identità" altamente specifico per le molecole mirate. Ciò che la collaborazione Monaco-Francoforte ha consentito è un metodo robusto e reversibile per eseguire questa messa a punto:dotare un sensore di nanopori inorganici con funzionalità biologica ancorando recettori molecolari al suo interno. Le squadre erano guidate dal Dr. Ulrich Rant, del Walter Schottky Institute di TUM e del TUM Institute for Advanced Study, e il Prof. Dr. Robert Tampé dell'Istituto di Biochimica dell'Università Goethe di Francoforte e del Cluster of Excellence Frankfurt (CEF) Macromolecular Complexes.
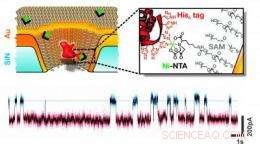
Questa illustrazione schematica mostra un nanoporo allo stato solido rivestito d'oro che è chimicamente modificato con un singolo recettore in grado di legare molecole proteiche con un insieme specifico di residui di amminoacidi. Una traccia esemplare corrente-tempo mostra il legame transitorio di singole proteine. Credito:gruppo di Rant, TU Monaco di Baviera, Copyright TU Muenchen.
"Ciò che trovo sorprendente dei nanopori, "Rant dice, "è il loro rapporto costo-efficacia:è già possibile eseguire esperimenti con una singola molecola con apparecchiature del valore di solo un paio di migliaia di euro. Se la tecnologia viene ulteriormente commercializzata, Sono sicuro che gli strumenti potrebbero essere venduti al prezzo di un personal computer, potenzialmente consentendo alle persone di rilevare singole molecole a casa".
La fabbricazione di questi dispositivi sperimentali è iniziata con un substrato di nitruro di silicio spesso appena 50 nanometri; quindi la membrana era letteralmente un chip semiconduttore (sebbene no, Certo, un circuito integrato). Strumenti standard dell'industria della microelettronica, litografia a fascio di elettroni e incisione con ioni reattivi, sono stati utilizzati per perforare la membrana di nitruro di silicio con nanopori da 20 a 50 nm di diametro. La deposizione da vapore è stata utilizzata per rivestire i pori con titanio e oro, e il metallo a sua volta ha ricevuto un rivestimento chimico autoassemblato dello spessore di uno strato molecolare. I nanopori risultanti avevano una forma conica affusolata con un diametro all'estremità stretta di circa 25 nm; ancorato allo strato superficiale c'era un piccolo numero di recettori biochimici progettati per catturare e immobilizzare la proteina che avrebbe dato al sensore la sua funzionalità biologica. Per questi esperimenti, i chip sono stati montati in una camera di misura con una soluzione elettrolitica su entrambi i lati; le molecole proteiche aggiunte a un lato della camera sono state spinte attraverso il nanoporo da una carica elettrica. Tracce di cambiamenti nella corrente elettrica hanno prodotto misurazioni in tempo reale di singole molecole mentre passavano attraverso i nanopori – o indugiavano mentre interagivano con la proteina immobilizzata – e questi dati a loro volta hanno fornito un'identificazione positiva delle molecole bersaglio.

Il rendering di questo artista illustra come singole proteine vengono sondate con nanopori ingegnerizzati in modo anartificiale in una membrana metallizzata allo stato solido. Una proteina primaria (rosso scuro) ancorata all'interno del poro lega transitoriamente un anticorpo IgG (rosso chiaro) che passa attraverso il poro. Il tempo di interazione può essere misurato elettricamente (un esempio di traccia corrente-tempo è mostrato nella parte superiore dell'immagine); questo rivela la funzione biologica dell'anticorpo. Un tappeto di molecole autoassemblate (peli bianchi) viene utilizzato per rivestire le pareti dei pori dorati, rendendo la superficie biologicamente inerte. Credito:Christof Hohmann, Iniziativa sui nanosistemi di cluster di eccellenza Monaco di Baviera (NIM), copyright NIM
I ricercatori sono stati in grado di rilevare proteine ricombinanti etichettate con istidina, e anche per discriminare tra sottoclassi di anticorpi IgG naturali (di ratti e criceti). Nel passato, questo livello di selettività potrebbe essere raggiunto solo a spese della sensibilità della singola molecola. I risultati riportati in Nanotecnologia della natura mostrare che questo ostacolo può essere superato, e altro ancora, che l'approccio è estremamente versatile. Come spiega Rant, "Il metodo che abbiamo impiegato per ancorare singole proteine all'interno del poro è abbastanza generico e funziona per molte proteine ricombinanti disponibili. Quindi è facile dotare il nanoporo allo stato solido della funzionalità biologica desiderata. Basta selezionare una proteina adatta, che riconosce specificamente le proteine bersaglio di interesse, e usarlo per sondare le proteine mentre passano."
"Il futuro rimane eccitante, "Tampè dice, "perché la natura è molto più avanti di noi in termini di selettività e specificità. Pertanto sono necessari ulteriori miglioramenti nel campo dei sistemi sensoriali artificiali a livello molecolare. La collaborazione tra i team di Monaco e Francoforte rappresenta un passo importante nella tecnologia biosensoriale e nanodiagnostica su il livello delle singole molecole." Rant aggiunge, "La maggior parte della recente ricerca sui nanopori è stata diretta verso il rilevamento e il sequenziamento del DNA. Spero che i nostri risultati mostrino che i nanopori hanno il potenziale per diventare strumenti importanti anche per la ricerca sulle proteine. E chi lo sa? Forse vedremo presto l'introduzione del nanoporo proteico. sensori come strumenti diagnostici per rilevare marcatori di malattie a bassa abbondanza nei campioni dei pazienti".