
Questa micrografia AFM di strati S 2-D assemblati su mica mostra due diversi percorsi di cristallizzazione, uno in cui i domini sono 2-3 nanometri più alti (cerchi punteggiati bianchi) rispetto all'altro. Differenze nei due profili di altezza, che sono stati misurati lungo le linee nere tratteggiate orizzontali, erano il risultato dell'intrappolamento cinetico. Credito:fonderia molecolare
(Phys.org)—Le proteine sono in grado di autoassemblarsi in un'ampia gamma di strutture altamente ordinate che presentano una vasta gamma di proprietà. Attraverso la biomimetica, un'innovazione tecnologica ispirata alla natura, gli esseri umani sperano di emulare le proteine e produrre la nostra versione di molecole autoassemblanti. Una chiave per raggiungere questo obiettivo è capire come il ripiegamento delle proteine - un processo fondamentale per la forma e la funzione di una proteina - viene esteso dalle singole proteine agli assemblaggi complessi.
I ricercatori del Lawrence Berkeley National Laboratory (Berkeley Lab) del Dipartimento dell'Energia degli Stati Uniti hanno ora dimostrato che un concetto ampiamente accettato per descrivere il ripiegamento di una singola proteina è applicabile anche all'autoassemblaggio di più proteine. I loro risultati forniscono importanti linee guida per futuri sforzi di biomimetica, in particolare per la fabbricazione di dispositivi e la sintesi su scala nanometrica.
"Abbiamo fatto le prime osservazioni dirette che il concetto di un imbuto pieghevole con trappole di energia cinetica per singole proteine può essere ugualmente applicato all'assemblaggio di strutture proteiche ordinate, " dice Jim De Yoreo, uno scienziato della Fonderia Molecolare, un centro di nanoscienze DOE presso il Berkeley Lab, che ha condotto questa ricerca insieme alla chimica del Berkeley Lab Carolyn Bertozzi. "I nostri risultati ci dicono che gli sforzi per scoprire e codificare le regole di progettazione per l'autoassemblaggio di sistemi molecolari complessi dovranno tenere conto dell'impatto delle trappole cinetiche associate alle trasformazioni conformazionali".
DeYoreo e Bertozzi sono gli autori corrispondenti di un articolo pubblicato dal Atti dell'Accademia Nazionale delle Scienze (PNAS) che ha riportato questa ricerca. Il documento è intitolato "Osservazione diretta di trappole cinetiche associate a trasformazioni strutturali che portano a più percorsi di assemblaggio dello strato S". I co-autori dell'articolo erano Seong-Ho Shin, Sungwook Chung, Babak Sanii e Luis Comolli.
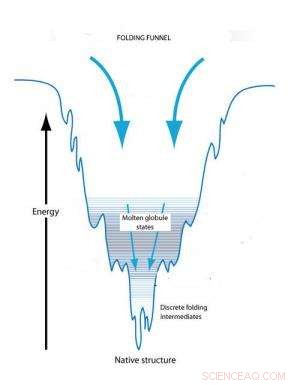
Il concetto di imbuto pieghevole spiega il ripiegamento delle proteine sulla base dei cambiamenti conformazionali per raggiungere uno stato di energia libera minima. Una proteina non ripiegata inizia in uno stato di alta libera e raggiunge il suo stato nativo a un'energia minima. Le trappole cinetiche lungo il percorso possono creare globuli fusi transitori e pieghevoli intermedi.
Le proteine sono essenzialmente nanomacchine biomolecolari in grado di svolgere numerosi compiti grazie alla loro capacità di ripiegarsi in una moltitudine di forme e forme. Quando singole proteine si autoassemblano in strutture ordinate, l'insieme risultante adotta spesso conformazioni ben distinte da quelle dei singoli componenti.
"Per esempio, matrici di collagene, che costituiscono le impalcature organiche di ossa e denti, sono costituiti da triple eliche di singoli monomeri di collagene, "Dice DeYoreo. "Queste eliche si uniranno ulteriormente in fibrille attorcigliate altamente organizzate che mostrano una simmetria pseudoesagonale".
Il concetto di imbuto pieghevole spiega il ripiegamento delle singole proteine sulla base dei cambiamenti conformazionali per raggiungere uno stato di energia libera minima. Una proteina spiegata inizia in uno stato di alta energia libera che rende instabile la sua conformazione. Inizialmente, ci sono una serie di possibili conformazioni tridimensionali che ridurrebbero questa energia libera. Però, quando la proteina inizia a ripiegarsi, l'energia libera inizia a diminuire e il numero di possibili conformazioni inizia a diminuire come la larghezza restringente di un imbuto. Il fondo dell'imbuto viene raggiunto quando l'energia libera è ridotta al minimo e c'è solo una conformazione disponibile. Quando l'energia libera diminuisce, però, potrebbero esserci trappole cinetiche lungo il percorso che possono fermare il processo di piegatura e trattenere la proteina in conformazioni parzialmente piegate, noti come globuli fusi e intermedi pieghevoli, per lunghi periodi di tempo. Alla fine questi stati conformazionali intrappolati saranno trasformati in una conformazione stabile ma la forma e la forma di quella conformazione finale è influenzata dalle trappole cinetiche.
"In un imbuto pieghevole proteico, si presume che le pareti dell'imbuto non siano lisce e i dossi e gli avvallamenti risultanti definiscono trappole cinetiche, " Dice DeYoreo. "Questa immagine fisica del ripiegamento è stata esplorata in dettaglio a livello di singola molecola, ma non è stato considerato per l'autoassemblaggio delle proteine in architetture estese anche se le trasformazioni conformazionali sono parte integrante del processo di autoassemblaggio".
De Yoreo, Bertozzi e i loro colleghi hanno preso provvedimenti per correggere questo deficit di conoscenza studiando le proteine dello strato superficiale (strato S) che si autoassemblano in una membrana cristallina attorno alle singole cellule di batteri e Archaea. Questa membrana esterna funge da primo punto di contatto tra il microbo e il suo ambiente ed è fondamentale per la capacità del microbo di sopravvivere. Utilizzando in situ Atomic Force Microscopy (AFM), i ricercatori hanno ripreso in tempo reale ea livello molecolare l'intrappolamento cinetico durante l'autoassemblaggio 2D delle strutture proteiche dello strato S sulle superfici di mica.
"Abbiamo osservato che l'autoassemblaggio delle proteine dello strato S segue due percorsi diversi, uno che porta direttamente alla finale a basso consumo energetico, stato ordinato, e l'altro che porta a una trappola cinetica occupata da uno stato transitorio di lunga durata che è più disordinato, " Dice DeYoreo. "Anche se entrambi gli stati sono facilmente accessibili durante la nucleazione dei cristalli, se il sistema cade nello stato di alta energia, fuga in finale, lo stato a bassa energia è fortemente ostacolato a temperatura ambiente. Ciò dimostra l'importanza delle trappole cinetiche nel determinare il percorso della cristallizzazione dello strato S e suggerisce che il concetto di imbuti pieghevoli è ugualmente valido per l'autoassemblaggio di strutture proteiche estese".