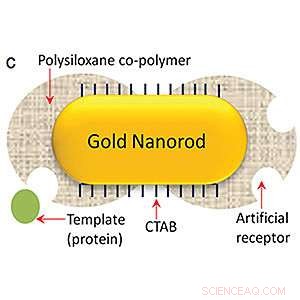
Srikanth Sinamaneni, dottorato di ricerca, e il team di ricerca ha utilizzato un processo chiamato imprinting biomolecolare per creare il biosensore plasmonico. Questo processo prevede il fissaggio delle proteine bersaglio alla superficie dei nanotubi, quindi aggiungendo piccole molecole attorno alle proteine per formare uno strato polimerico attorno all'esterno dei nanotubi. Le proteine bersaglio vengono rimosse per lasciare cavità sulla superficie dei nanotubi, quali sono gli anticorpi artificiali. Quando i nanotubi con gli anticorpi artificiali sono esposti a una sostanza, come l'urina, che contiene la proteina bersaglio, quelle proteine si depositano nelle cavità, simile a un pezzo di puzzle che si inserisce in un puzzle.
(Phys.org)—Rilevare se un paziente avrà un danno renale acuto potrebbe diventare semplice come immergere una striscia reattiva di carta stampata con nanobarre d'oro in un campione di urina, ha scoperto un team di ricercatori della Washington University di St. Louis.
Srikanth Singamaneni, dottorato di ricerca, professore assistente di ingegneria, insieme a Evan Kharasch, dottore, dottorato di ricerca, e Jerry Morrissey, dottorato di ricerca, alla Washington University School of Medicine, hanno sviluppato un sensore biomedico utilizzando nanobarre d'oro progettati per rilevare l'elevazione della proteina neutrofila lipocalina associata alla gelatinasi (NGAL), un promettente biomarcatore per il danno renale acuto, nelle urine. I biomarcatori sono in genere piccole molecole o proteine nel corpo la cui concentrazione cambia in risposta alla malattia o alla terapia.
"Questa tecnologia altamente promettente e innovativa offre il potenziale per portare i test di funzionalità renale al capezzale, con maggiore accessibilità e minor costo, "dice Kharasch, il Russell e Mary Shelden Professore di Anestesiologia e professore di biochimica e biofisica molecolare. "Inoltre, questo test di prova del concetto può essere molto più ampiamente applicabile a vari tipi di test clinici e biomarcatori, consentendo la creazione di molti nuovi saggi, in modo più rapido ed economico".
danno renale acuto, che si verifica quando i reni non riescono a filtrare i prodotti di scarto dal sangue, si sviluppa rapidamente in poche ore o pochi giorni. È comune nelle persone ricoverate in ospedale, in particolare in quelle persone in condizioni critiche o che hanno subito un intervento chirurgico al cuore. Ad oggi, non ci sono stati sensori in grado di rilevare facilmente se una persona subirà un danno renale acuto.
"Se riusciamo a trovare una tecnologia economica che possa essere utilizzata in modo più efficiente, possiamo prenderlo molto prima e salvare molte vite, "dice Singamaneni, un ingegnere in scienza dei materiali e ingegneria meccanica. "Il nostro obiettivo è essere in grado di stampare questo sensore su un pezzo di carta con una stampante a getto d'inchiostro di tutti i giorni, in modo che medici e cliniche abbiano a disposizione un test economico quando ne hanno bisogno".
Per creare il sensore, il team ha utilizzato una tecnica chiamata biorilevamento plasmonico, che è in grado di rilevare quantità molto piccole di biomarcatori. Però, gli anticorpi naturali hanno una breve durata di conservazione e sono costosi e richiedono molto tempo per lo sviluppo e l'applicazione, così Singamaneni e il team hanno creato anticorpi artificiali. Per creare il biosensore plasmonico, hanno usato un processo chiamato imprinting biomolecolare.
Questo processo prevede il fissaggio delle proteine bersaglio alla superficie dei nanotubi, quindi aggiungendo piccole molecole attorno alle proteine per formare uno strato polimerico attorno all'esterno dei nanotubi. Le proteine bersaglio vengono rimosse per lasciare cavità sulla superficie dei nanotubi, quali sono gli anticorpi artificiali. Quando i nanotubi con gli anticorpi artificiali sono esposti a una sostanza, come l'urina, che contiene la proteina bersaglio, quelle proteine si depositano nelle cavità, simile a un pezzo di puzzle che si inserisce in un puzzle.
"Quando fai brillare la luce sui nanotubi d'oro, gli elettroni del metallo si eccitano e iniziano a oscillare, " dice Singamaneni. "Ci sono due bande, o colori, di luce nello spettro del nanorod d'oro che mostrano quale parte della luce viene assorbita e dispersa dal nanorod. Quando qualcosa si attacca alla superficie del nanorod d'oro, sposterà la posizione di una delle bande e cambierà il colore. Quel colore ci dice se il biomarcatore proteico si è legato al nanorod d'oro. Quindi possiamo misurare la quantità di biomarcatore in base alla quantità di cambiamento di colore".
Il team prevede di utilizzare il suo successo utilizzando NGAL come biomarcatore come modello per sostituire gli anticorpi naturali con anticorpi artificiali per altre proteine. Nel 2010, Kharasch e Morrissey, professore di anestesiologia, hanno scoperto che le proteine acquaporina-1 e adipofilina erano elevate nelle urine dei pazienti con le forme più comuni di cancro del rene.