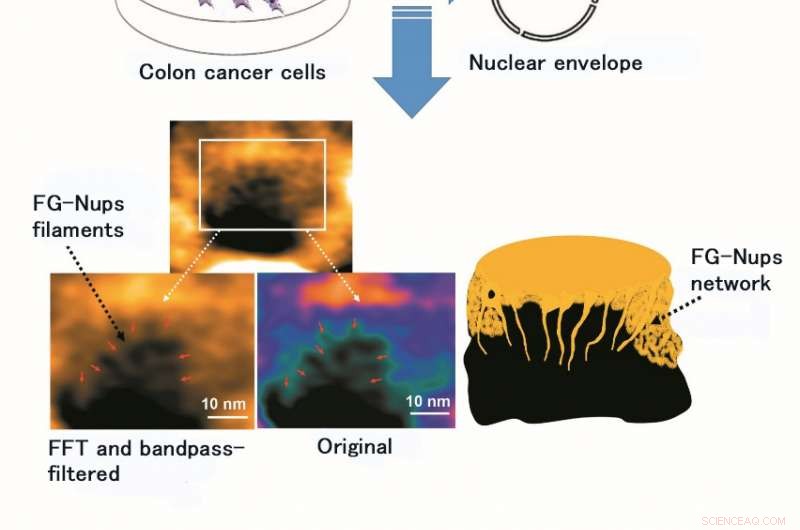
L'utilizzo di HS-AFM ha consentito l'osservazione e l'imaging video della struttura e della dinamica del filamento FG-Nups, un complesso proteico di rivestimento morbido e flessibile. La figura mostra l'immagine originale del filamento FG-Nups e quella dopo l'elaborazione mediante Fast Fourier Transform (FFT) e un filtro passa-banda (un filtro passa-banda consente la permeazione solo di determinate lunghezze d'onda della luce). Credito:Università di Kanazawa
Uno dei motivi principali della mortalità per cancro è il comportamento altamente invasivo delle cellule tumorali, che è spesso dovuto a metastasi aggressive. La metastasi è facilitata da vari fattori di crescita e citochine secrete dalle cellule del sistema immunitario, che operano attraverso varie vie di segnalazione. Sorprendentemente, queste vie di segnalazione entrano nel nucleo attraverso il complesso dei pori nucleari (NPC), che dovrebbe fungere da portinaio al nucleo. NPC è, infatti, una nanomacchina costituita da più copie di circa 30 proteine diverse, chiamati collettivamente nucleoporina.
Sebbene le piccole molecole siano in grado di attraversare i pori nucleari piuttosto liberamente, molecole più grandi di 40 kDa potrebbero farlo efficacemente solo legandosi a specifiche proteine trasportatrici che interagiscono con FG-Nups (le nucleoporine hanno unità ripetitive di due amminoacidi fenilalanina (F) e glicina (G), quali sono le proteine tentacolari che hanno ruoli specifici e selettivi nel trasporto dei pori. Sebbene vengano proposti diversi modelli, come FG-Nups partecipi al trasporto nucleo-citoplasma rimane in gran parte sconosciuto. Ciò nonostante, la valutazione concomitante delle strutture e delle dinamiche nanoscopiche è stata tecnicamente irrealizzabile, una situazione prevalente in tutta la ricerca in biologia cellulare. Si pensava che la visualizzazione diretta delle dinamiche NPC a risoluzione su scala nanometrica fosse impossibile.
Il team di ricerca dell'Università di Kanazawa ha studiato questo importante problema e ha ottenuto risultati rivoluzionari combinando l'imaging cellulare vivo ad alta risoluzione, microscopio elettronico, e AFM ad alta velocità (HS-AFM) che è sviluppato da loro stessi per studiare le dinamiche spaziali e temporali nanoscopiche native nelle strutture NPC nelle cellule del cancro del colon.
Primo, hanno generato linee cellulari NPC stabili che esprimono GFP (proteina fluorescente verde) e sono state confermate dalla microscopia a fluorescenza. Prossimo, hanno isolato l'involucro nucleare altamente purificato che è stato confermato dall'uso della microscopia elettronica a colorazione negativa e della microscopia confocale. Quindi, hanno iniziato l'osservazione dei cambiamenti spazio-temporali a scala millisecondo e nanometrica della struttura NPC dello stato nativo nelle cellule del cancro del colon combinando l'imaging ad alta risoluzione delle cellule vive e la microscopia elettronica. In particolare, hanno eseguito l'osservazione dell'involucro nucleare vivente e dei pori nucleari utilizzando HS-AFM.
Il gruppo di ricerca dell'Università di Kanazawa era, infatti, successo nell'imaging della dinamica delle proteine NPC nelle cellule tumorali, che sono gli elementi costitutivi del poro nucleare (Figura 1). MLN8237/alisertib, un induttore apoptotico e autofagico, è attualmente in fase di numerosi studi clinici sul cancro. Questo farmaco è stato segnalato per inibire l'espressione e le attività della nucleoporina. I ricercatori hanno visualizzato FG-Nups nativi e trattati con farmaci da HS-AFM. In particolare, i FG-Nups estesi e retratti con l'aspetto di una ragnatela di ragno sono stati persi nei campioni trattati con il farmaco (Figura 2). Il team di ricerca ha concluso che tramite HS-AFM, hanno visualizzato la deformazione e la perdita della barriera dei pori nucleari FG-Nups, che potrebbe essere il primo codice nano morente scoperto al mondo.
Il presente studio del gruppo di ricerca dell'Università di Kanazawa ha consentito la visualizzazione della struttura e della dinamica del poro della membrana nucleare su scala nanometrica, ed è dimostrato che la deformazione e la perdita della barriera dei pori della membrana nucleare sarebbe uno dei codici morenti delle cellule cancerose. Questi risultati rappresentano un nuovo paradigma nella nostra comprensione del trasporto nucleare, che ha, fino a questo punto, rimase un problema enigmatico in tutto il campo della nanomedicina e della biologia cellulare. I risultati attuali si basano sulla tecnologia di bio-immagine di punta sviluppata presso l'Università di Kanazawa. Questo studio ha applicazioni mediche tra cui agire come una nuova "nanoendoscopia" per visualizzare organelli intracellulari come il nucleo e i pori nucleari, e dinamica molecolare nelle cellule tumorali e in altre malattie.
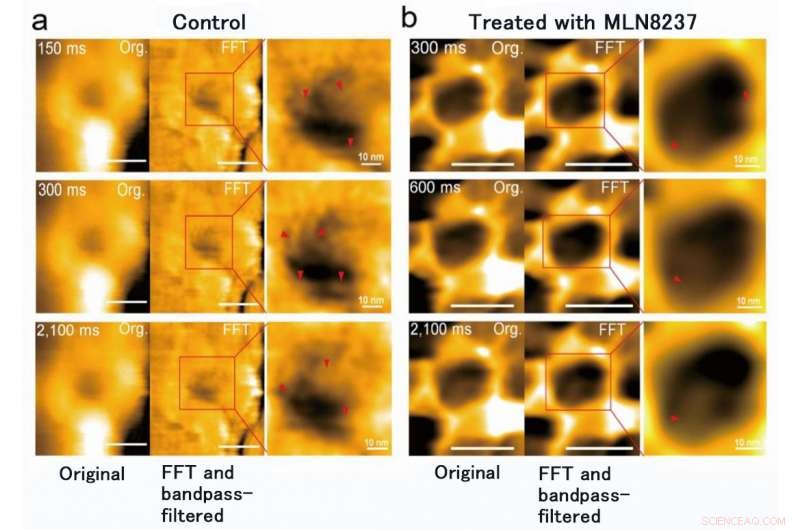
Il trattamento MLN8237 delle cellule tumorali ha causato la deformazione e la perdita della barriera FG-Nups. È stato anche scoperto che il diametro interno del poro nucleare è cambiato da 86 ± 13 nm a 53 ± 9 nm e la profondità, da 4 ± 2 nm a 7 ± 1 nm. Credito:Università di Kanazawa