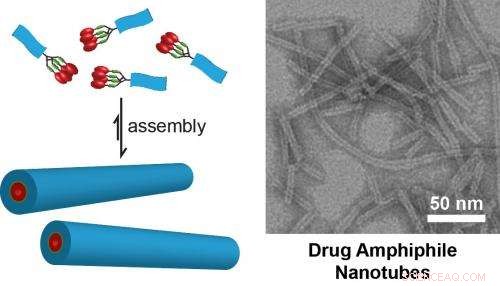
(Sinistra) Illustrazione schematica del concetto di design per anfifili drogati autoassemblanti. Il caricamento del farmaco all'interno delle nanostrutture autoassemblate è definito dalla natura del design molecolare. (A destra) Immagine TEM di nanotubi formati dall'autoassemblaggio di un farmaco anfifilo contenente quattro farmaci camptotecina. Questi nanotubi possiedono un carico di droga fisso del 38% (p/p). Immagine dal Cui Lab della Johns Hopkins University. Credito:Cui Lab, Dipartimento di Ingegneria Chimica e Biomolecolare, Università Johns Hopkins
(Phys.org) — Negli ultimi anni, molti popolari trattamenti contro il cancro hanno utilizzato nano, questo è, minuscole particelle di polimeri o materiali a base di carbonio per trasportare i farmaci chemioterapici ai tumori in modo mirato specificamente alle cellule tumorali, risparmiando le cellule normali. Ma questo approccio ha diversi problemi.
Tra l'altro, è difficile controllare la quantità di farmaco caricata nel vettore, e, infatti, troppo spesso c'è molto più materiale "vettore" che farmaco. Di conseguenza, la quantità di farmaco varia spesso da particella a particella, il che significa che la dose di chemioterapia erogata può essere incoerente o irregolare. Anche, il materiale sintetico che racchiude e rilascia il farmaco può essere esso stesso tossico, causando effetti collaterali indesiderati.
Lo scenario ideale sarebbe trovare un modo per trasformare i farmaci antitumorali nei propri sistemi di somministrazione, ed eliminare del tutto i veicoli sintetici.
Honggang Cui, assistente professore di ingegneria chimica e biomolecolare presso la Johns Hopkins University sta cercando di fare proprio questo trasformando le molecole dei farmaci in un modo che permetta loro di diventare i propri vettori, un processo noto come autoassemblaggio.
"Vogliamo usare il farmaco antitumorale per creare nanoparticelle da se stesso, "dice Cui, anche un membro di facoltà affiliato del Johns Hopkins Institute for NanoBioTechnology. "La sfida è:come lo facciamo?"
Lo scienziato finanziato dalla National Science Foundation (NSF) e il suo team di ricerca stanno utilizzando nuove tecniche di ingegneria molecolare che sperano spingano le molecole dei farmaci a organizzarsi in nanostrutture discrete e isolate, piuttosto che rimanere nella loro attuale forma "di massa".
Se ha successo, il lavoro potrebbe potenzialmente migliorare la chemioterapia antitumorale aumentando l'efficacia del trattamento, e riducendo i suoi effetti collaterali negativi.
Attualmente, "in una particella potresti avere il 2% di carico di droga, e in un altro, forse il 10 per cento, e in un altro, niente, nessuna droga, " dice. Far trasportare i farmaci da soli "aiuterà l'esito clinico, " Cui aggiunge. "Non otterrai troppo o troppo poco di una droga. Avrai la dose giusta."
Al fine di trasformare questi farmaci nei propri sistemi di consegna su scala nanometrica, devono diventare anfifilici, il che significa che devono avere proprietà che amano e non amano l'acqua.
"Il segmento anti-acqua spingerà le molecole a unirsi per formare un cluster molecolare, o una nanostruttura, in modo da ridurre al minimo il loro contatto con le molecole d'acqua, mentre il segmento simile all'acqua manterrà la nanostruttura solubile in soluzione acquosa e impedirà loro di crescere in oggetti più grandi, "Ci spiega.
Pochi farmaci hanno questa dualità quando si tratta di acqua. "La maggior parte sono molto idrofobi; hanno scarsa solubilità in acqua, " lui dice.
Per rendere le droghe che odiano l'acqua capaci di amare anche l'acqua, i ricercatori stanno sperimentando peptidi solubili in acqua, che sono composti costituiti da due o più amminoacidi, cercando di incorporarli nei farmaci tramite linker biodegradabili, questo è, legami chimici che fungono da ponte tra il peptide che ama l'acqua e il farmaco che odia l'acqua.
Quando funziona, "il farmaco può diventare autoassemblante, " dice. "Quando il farmaco acquisisce la capacità di auto-assemblarsi, vogliamo giocare con la sequenza peptidica per ottenere il controllo delle sue dimensioni, chimica della forma e della superficie.
"Il peptide aggiungerà non solo il segmento che ama l'acqua per l'autoassemblaggio, ma anche nuove funzionalità che consentono un'efficace regolazione del loro assemblaggio in diverse dimensioni e forme, " aggiunge. "Potrebbero essere bioattivi, e presentare segnali per il targeting specifico del tumore".
La speranza è quella di produrre farmaci antitumorali che siano nanostrutture supramolecolari, o particelle costituite da più di una molecola, che "hanno un elevato carico di farmaci e un carico di farmaci fisso, " dice Cui.
"Il carico all'interno della nanostruttura è definito dal design molecolare, " aggiunge "Se la frazione del farmaco all'interno della molecola progettata è del 10 percento, anche la nanostruttura avrà il 10% di carico di farmaco. Perciò, attraverso la progettazione molecolare, si può regolare con precisione il caricamento del farmaco nella nanostruttura".
Cui sta conducendo la sua ricerca nell'ambito di un premio NSF Faculty Early Career Development (CAREER) a partire da quest'anno. Il premio sostiene i docenti junior che esemplificano il ruolo degli insegnanti-studiosi attraverso ricerche eccezionali, formazione eccellente e l'integrazione dell'istruzione e della ricerca nel contesto della missione della loro organizzazione. NSF sta finanziando il suo lavoro con circa $ 500, 000 in cinque anni.
Cui e il suo team hanno recentemente pubblicato i risultati del loro lavoro nel Giornale della Società Chimica Americana dimostrando il principio della costruzione di farmaci antitumorali supramolecolari auto-liberanti. Il loro lavoro ha prodotto nanofibre e nanotubi formati dall'autoassemblaggio di coniugati peptide-antitumorale.
Nell'ambito della promozione dell'istruzione della sovvenzione, Cui sta progettando di invitare gli studenti delle scuole superiori e medie locali a trascorrere del tempo nel suo laboratorio.
"La somministrazione di farmaci è intrinsecamente un campo multidisciplinare che offre enormi opportunità di istruzione a tutti i livelli, " dice. "Vogliamo in particolare coinvolgere gli studenti delle scuole pubbliche del centro città per conoscere i sistemi di somministrazione dei farmaci, e i modi migliori per migliorare il trattamento del cancro".
Mentre le sue idee sono ancora molto lontane dall'uso clinico, Cui crede che alla fine sarà possibile trasformare i farmaci in blocchi molecolari che agiranno come i propri sistemi di somministrazione.
"Non vedo alcun motivo per cui questi farmaci a rilascio automatico non possano essere tradotti in contesti clinici una volta individuati i modi per manipolare il loro comportamento di auto-assemblaggio, " lui dice.