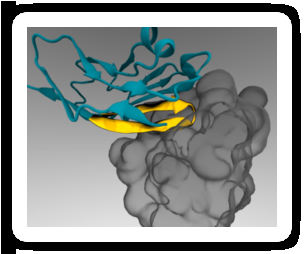
Un "passaporto" peptidico minimo (giallo) può essere attaccato alle nanoparticelle terapeutiche in modo che si leghi a un recettore delle cellule immunitarie (grigio) e prevenga l'inghiottimento. Credito:Diego Pantano
Gli scienziati hanno trovato un modo per intrufolare nanoparticelle che trasportano farmaci antitumorali oltre le cellule del sistema immunitario, che normalmente inghiottirebbe le particelle, impedendo loro di raggiungere il loro obiettivo. La tecnica sfrutta il fatto che tutte le cellule del corpo umano mostrano una proteina sulle loro membrane che funge da "passaporto" specifico per istruire le cellule immunitarie a non attaccarle. Attaccando un piccolo pezzo di questa proteina alle nanoparticelle, gli scienziati sono stati in grado di ingannare le cellule immunitarie nei topi nel riconoscere le particelle come "sé" piuttosto che estranee, aumentando così la quantità di farmaci somministrati ai tumori.
Nanotecnologia del cancro
Gli attuali approcci alla chemioterapia lasciano i pazienti con gravi effetti collaterali perché i farmaci antitumorali destinati a distruggere i tumori uccidono inavvertitamente le cellule sane nel corpo. Ma gli scienziati hanno recentemente sviluppato nanoparticelle che possono trasportare farmaci tossici direttamente sui tumori risparmiando i tessuti sani. A causa delle loro piccole dimensioni, le nanoparticelle fuoriescono dai vasi sanguigni che perdono, caratteristici dei tumori e si accumulano nel tessuto canceroso. Le cellule tumorali assorbono le particelle che rilasciano il loro contenuto tossico una volta all'interno. Questo sistema di somministrazione localizzato consente ai medici di somministrare ai pazienti dosi di farmaci più elevate di quelle normalmente tollerate.
Sono stati fatti precedenti tentativi per scongiurare l'attacco del sistema immunitario rivestendo densamente le nanoparticelle con "spazzole" di polietilenglicole (PEG) che bloccano fisicamente l'adesione delle proteine che normalmente si depositano su corpi estranei per attirare i macrofagi. Mentre questi pennelli ritardano l'inizio della risposta immunitaria, non lo impediscono.
L'ispirazione per il lavoro rivoluzionario di Discher risale a tredici anni quando un gruppo di ricercatori ha mostrato con topi geneticamente modificati che una proteina chiamata CD47, che si trova nelle membrane cellulari di quasi tutti i mammiferi, interagisce con un recettore sui macrofagi chiamato SIRPa, e, così facendo, segnala che la cellula è nativa e non dovrebbe essere distrutta. I risultati si sono basati sull'eliminazione del CD47 del mouse e hanno sollevato molte domande, compreso come sopravvivono tali topi e se vi fosse rilevanza per gli esseri umani.
Discher, che stava progettando nanoparticelle che si autoassemblano in varie forme al momento della scoperta, si rese conto che il meccanismo di auto-riconoscimento del CD47-SIRPa poteva, in linea di principio, essere sfruttato per aiutare le nanoparticelle a intrufolarsi nel sistema immunitario. Ma era anche chiaro che le versioni umane delle proteine purificate dovevano essere studiate per qualsiasi traduzione nell'uomo.
Nel 2008, Il laboratorio di Discher ha dimostrato che il CD47 umano agisce in modo simile al CD47 del topo come "marcatore di sé" tramite la segnalazione attraverso il recettore SIRPa. Poco dopo, un gruppo di ricercatori ha chiarito in dettaglio atomico la struttura combinata di CD47 umano e SIRPa. Il laboratorio di Discher ha utilizzato queste informazioni per condurre simulazioni al computer e identificare la più piccola porzione di CD47 che potrebbe ancora legarsi a SIRPa. Il risultato è stato un breve peptide che il laboratorio di Discher ha sintetizzato chimicamente e attaccato a nanoparticelle standard.
"Ridurre il CD47 a un peptide essenziale è stato un passo fondamentale, " ha detto Discher. "Il sequenziamento di migliaia di genomi umani in tutto il mondo ha recentemente rivelato molte variazioni nelle sequenze di CD47 e SIRPa. Avevamo bisogno di progettare un peptide "universale" che potesse legare SIRPa e funzionare in tutti gli esseri umani nonostante queste differenze".
Le nanoparticelle stealth evitano la risposta immunitaria
Per verificare se il loro peptide potrebbe aiutare le nanoparticelle a eludere il sistema immunitario, Il team di Discher ha iniettato nei topi sia nanoparticelle legate a peptidi che nanoparticelle prive di CD47. Entrambi i tipi di nanoparticelle contenevano un colorante fluorescente che ha permesso agli scienziati di tracciare le particelle. In un articolo pubblicato il 22 febbraio, 2013 in Scienza , i ricercatori hanno riferito che in soli trenta minuti dopo l'iniezione delle particelle, il sangue dei topi conteneva quattro volte il numero di nanoparticelle contenenti il peptide CD47 rispetto alle particelle senza il peptide, suggerendo che le particelle legate al CD47 venivano viste dai macrofagi come simili alle cellule che appartenevano al corpo.
Incoraggiato da questi primi risultati, il team ha poi riempito le loro nanoparticelle legate al CD47, così come nanoparticelle rivestite con PEG senza CD47, con il farmaco antitumorale paclitaxel più un anticorpo contro il tumore. Il team ha iniettato separatamente entrambi i tipi di nanoparticelle e Cremophore, il vettore standard per paclitaxel, in topi con tumori simili all'uomo. Dopo solo un giorno, i tumori nei topi iniettati con nanoparticelle legate al CD47 erano il 70% delle dimensioni di quelli iniettati con le nanoparticelle rivestite con PEG. Inoltre, Le nanoparticelle legate al CD47 erano altrettanto buone o migliori nel ridurre i tumori come Cremophore senza causare effetti collaterali. Il team ha continuato a documentare i cambiamenti molecolari che si verificano all'interno dei macrofagi quando il CD47 inibisce l'engulfment, suggerendo che ulteriori farmaci potrebbero essere usati per inibire la clearance.
"Sono attualmente in corso studi clinici che utilizzano nanoparticelle per fornire farmaci antitumorali, ma l'eliminazione da parte del sistema immunitario rimane un ostacolo significativo, " ha detto Karen Peterson, dottorato di ricerca, Senior Advisor di programmi extramurali presso NIBIB. "Il lavoro di Discher è un approccio elegante, che potrebbe consentire ad altre nanoterapie di essere efficaci negli studi clinici fornendo una "autenticazione" molecolare che il corpo non riconosce come estranea".
Peterson ha anche notato la combinazione di bioingegneria e modellazione computerizzata che ha portato alla generazione del peptide; La capacità di Discher di testare prima la funzione di peptidi di dimensioni diverse tramite simulazione al computer, e poi produrre un peptide artificiale basato su queste simulazioni gli ha permesso di eliminare parte del gioco di indovinelli, risparmiando tempo e denaro nel lungo periodo.
Applicazioni future
Discher ipotizza che il suo peptide CD47 potrebbe essere utilizzato in modo simile per prevenire l'eliminazione immunitaria dei virus utilizzati per fornire geni per il trattamento di terapia genica o per migliorare la biocompatibilità e la durata di oggetti estranei più grandi come pacemaker e impianti, le cui parti possono degradarsi nel tempo a causa degli attacchi del sistema immunitario.