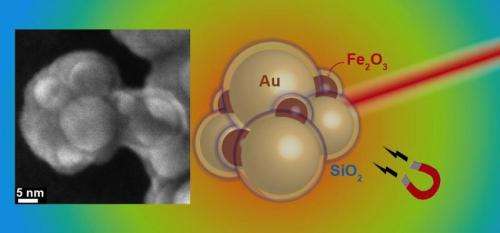
Schema di aggregati di oro e ossido di ferro con guscio di silice. A sinistra:immagine al microscopio elettronico di un aggregato. Credito:Georgios Sotiriou / ETH Zürich
Le nanoparticelle hanno un grande potenziale in medicina:per la diagnostica, come veicolo per sostanze attive o strumento per uccidere i tumori usando il calore. I ricercatori dell'ETH di Zurigo hanno ora sviluppato particelle relativamente facili da produrre e con un'ampia gamma di applicazioni.
Se metti la mano su una torcia accesa al buio, sembra brillare di rosso. Questo perché i raggi di luce rossa a lunghezza d'onda lunga penetrano nei tessuti umani in modo più efficace rispetto alla luce blu a lunghezza d'onda corta. I ricercatori dell'ETH di Zurigo sfruttano questo fatto in un nuovo tipo di nanoparticelle:le cosiddette particelle plasmoniche, che si riscaldano quando assorbono la luce del vicino infrarosso. Ciò potrebbe consentire loro di uccidere il tessuto tumorale con il calore, ad esempio.
L'oro è un materiale popolare per le nanoparticelle usate terapeuticamente, in quanto è ben tollerato e di solito non provoca reazioni indesiderate. Nella caratteristica forma a sfera o sfera delle nanoparticelle, però, l'oro non ha le proprietà necessarie per funzionare come una particella plasmonica che assorbe sufficientemente nello spettro della luce del vicino infrarosso per riscaldarsi. Fare così, deve essere modellato in una forma speciale, come una canna o un guscio, in modo che gli atomi d'oro adottino una configurazione che inizia ad assorbire la luce del vicino infrarosso, generando così calore. La produzione di tali nanobarre o nanoshell in quantità sufficienti, però, è complesso e costoso.
Aggregati al posto dei bastoncelli
Un team di ricercatori guidato da Sotiris Pratsinis, Professore di Tecnologia delle particelle all'ETH di Zurigo, ha ora scoperto un trucco per fabbricare particelle d'oro plasmoniche in grandi quantità. Hanno usato il loro know-how esistente sulle nanoparticelle plasmoniche e hanno realizzato nanoparticelle d'oro a forma di sfera che mostrano le proprietà plasmoniche del vicino infrarosso desiderate, consentendo loro di essere aggregate. Ogni particella viene preventivamente rivestita con uno strato di biossido di silicio, che funge da segnaposto tra le singole sfere nell'aggregato. Attraverso la distanza definita con precisione tra diverse particelle d'oro, i ricercatori trasformano le particelle in una configurazione che assorbe la luce del vicino infrarosso e quindi genera calore.
"Il guscio di biossido di silicio ha un altro vantaggio", spiega Georgios Sotiriou, primo autore dello studio e, fino a poco tempo fa, un postdoc nel gruppo di ricerca di Pratsinis e attualmente membro della Swiss National Science Foundation presso l'Università di Harvard:"Previene la deformazione delle particelle quando si riscaldano". Questo è un grosso problema con i nanorod. Se le bacchette perdono la loro forma durante il riscaldamento, perdono le proprietà plasmoniche desiderate e non sono più in grado di assorbire abbastanza luce nel vicino infrarosso per generare calore.
I ricercatori hanno già testato le nuove particelle sulle cellule del cancro al seno in una capsula di Petri e hanno scoperto che dopo l'esposizione alla luce del vicino infrarosso le nanoparticelle si sono riscaldate a sufficienza per uccidere le cellule, mentre le cellule sono sopravvissute in esperimenti di controllo (con particelle ma senza radiazioni e con radiazioni ma senza nanoparticelle).
Combinazione con un grande potenziale
Per poter indirizzare le particelle in modo specifico verso il tessuto canceroso, i ricercatori hanno anche mescolato particelle di ossido di ferro superparamagnetico con le particelle d'oro, che consentono di controllare i nanoaggregati tramite campi magnetici e possono aumentare il loro accumulo in un tumore. Inoltre, questo apre la possibilità di riscaldare gli aggregati in strati profondi di tessuto che la luce infrarossa non può più raggiungere tramite l'ipertermia magnetica. Qui, il riscaldamento delle particelle è indotto da un campo magnetico, dove i poli positivo e negativo si alternano rapidamente.
"Molte domande devono ancora essere risolte prima che le particelle possano essere utilizzate negli esseri umani", dice Jean-Christophe Leroux, Professore di Formulazione e somministrazione di farmaci all'ETH di Zurigo, che è stato anche coinvolto nel progetto di ricerca. Sebbene oro, il biossido di silicio e l'ossido di ferro sono ben tollerati, cosa succede agli aggregati di particelle nel corpo nel corso del tempo - se si accumulano nel fegato o vengono scomposti ed espulsi, per esempio, deve ancora essere indagato.
Le nanoparticelle ibride di ossido di ferro-oro non solo sono in grado di uccidere le cellule tumorali attraverso il calore; potrebbero anche essere utilizzati come mezzo di contrasto per i processi di imaging nella diagnostica mediante risonanza magnetica, come studiato in collaborazione con l'Ospedale universitario di Zurigo, o come parte di un veicolo che trasporta sostanze attive. "Potresti persino accoppiare le particelle con vettori di farmaci sensibili alla temperatura, che poi consentirebbe il rilascio del farmaco se fosse superata una certa temperatura", spiega Sotiriou. Ciò consentirebbe di ridurre o addirittura evitare effetti collaterali indesiderati sul resto del corpo.