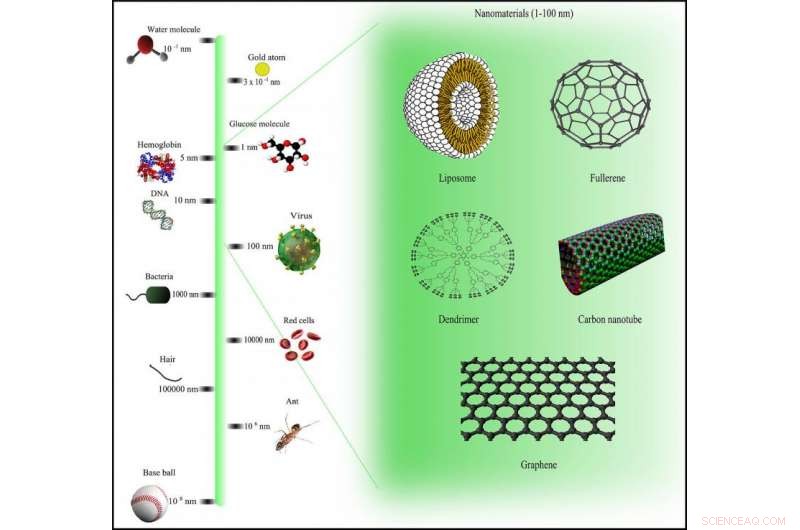
Scala di confronto dei nanomateriali tramite Wikimedia Commons con licenza CC BY-SA 3.0
Quando prendi un farmaco, viaggia attraverso il tuo flusso sanguigno, dissolvendosi e disperdendosi, ed eventualmente raggiungere la sua area di destinazione designata.
Ma poiché il sangue contenente il farmaco viaggia in tutto il corpo, solo una piccola percentuale della dose iniziale raggiunge effettivamente la posizione desiderata.
Per farmaci da banco come il paracetamolo o l'ibuprofene, con pochissimi effetti collaterali, questo non importa molto.
Ma quando si tratta di farmaci antitumorali, che può colpire le cellule sane tanto quanto le cellule cancerose, questo processo può causare grossi problemi.
In parte perché i farmaci sono diluiti nel loro sangue, i malati di cancro devono assumere questi farmaci in dosi particolarmente elevate e questo può causare effetti collaterali molto spiacevoli.
Ma la professoressa Sonia Trigueros, co-direttore dell'Oxford Martin Program on Nanotechnology, si sta avvicinando allo sviluppo di un sistema di somministrazione di farmaci su nanoscala con l'obiettivo di colpire specificamente le cellule tumorali.
Lavorando con un team di chimici, ingegneri e fisici, Trigueros ha intrapreso una missione ambiziosa per affrontare il cancro a livello "nano" - largo meno di 100 nanometri. Per contesto, questo è piccolissimo:un nanometro è un millesimo di millesimo di millimetro.
C'è ancora molta strada da fare, ma Trigueros sta facendo progressi decenti, e ha recentemente affrontato un grave problema di lavorare a livello nanometrico. E alla conferenza Wired Health di quest'anno, che ha esaminato il futuro dell'assistenza sanitaria, benessere e genomica – ci ha raccontato i suoi recenti progressi, e le sue visioni per il futuro.
A livello nano
Alcuni di noi ricorderanno la tavola periodica esposta nelle nostre aule di scienze che ci parlava delle proprietà di ciascun elemento. Ma lavorando a livello nano tutto cambia, e gli elementi si comportano in modo completamente diverso.
Gli elementi hanno proprietà diverse a livello nano rispetto a quanto hanno a livello micro, ha spiegato il Prof Trigueros al pubblico di Wired Health 2015.
Ciò pone grossi problemi ai ricercatori che cercano di realizzare dispositivi su nanoscala, che possono essere realizzati con diversi materiali, compreso l'oro, argento e carbonio. Tutti questi materiali sono altamente instabili a livello nano.
"Dopo aver realizzato le nanostrutture, hai solo da pochi minuti a un paio di giorni per lavorare, " ha detto. Sono davvero instabili, soprattutto quando li metti in acqua."
Questo non è l'ideale, considerando che i nostri corpi sono costituiti principalmente da acqua.
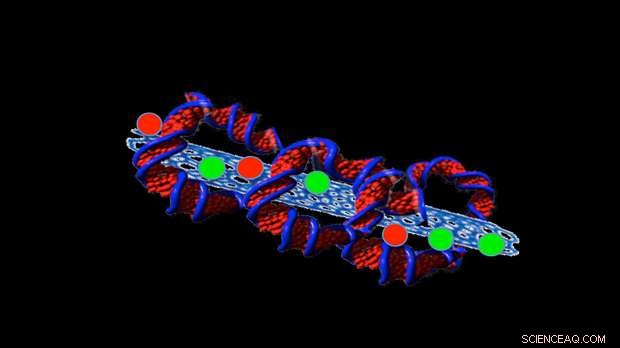
Credito:Professoressa Sonia Trigueros
Il recente lavoro di Trigueros si è concentrato sul tentativo di stabilizzare minuscoli tubi in carbonio, chiamati nanotubi di carbonio, che trattengono i farmaci all'interno del tubo in modo che possano essere consegnati nelle cellule tumorali.
Ora ha trovato un modo per mantenerli stabili per più di due anni e a temperature fino a 42ºC.
Per fare questo, avvolge il DNA attorno alle strutture, come una tortilla che avvolge il ripieno di un burrito.
Sebbene ciò raggiunga l'obiettivo di mantenere stabili le nanostrutture all'interno del corpo, ciò non serve a molto se il DNA non può disfarsi per fornire i farmaci. Ma, secondo Trigueros, lei ha dimostrato che, una volta dentro una cella, il DNA si svolge facilmente e rilascia il suo carico utile.
Consegna del farmaco veramente mirata
Quindi come fa tutto il lavoro? Come entrano i farmaci nelle cellule tumorali? I nanotubi di Trigueros sfruttano le differenze tra cellule cancerose e cellule sane – in questo caso, differenze nelle membrane che li tengono insieme.
"Le cellule cancerose sono più permeabili delle cellule normali, quindi i nanotubi possono attraversare la membrana cellulare. E una volta dentro, scartano e consegnano droga, " ha spiegato Trigueros.
Sfruttare le differenze nella loro permeabilità è un modo per colpire le cellule cancerose, ma Trigueros spiega che c'è più di un modo per creare un sistema di somministrazione dei farmaci veramente mirato.
"Possiamo attaccare quello che vogliamo sul DNA, " ha detto. "Così puoi attaccare una proteina che riconosce le cellule tumorali".
Dalla teoria alla realtà
Anche se tutto questo suona alla grande in teoria, funzionerà davvero nella realtà?
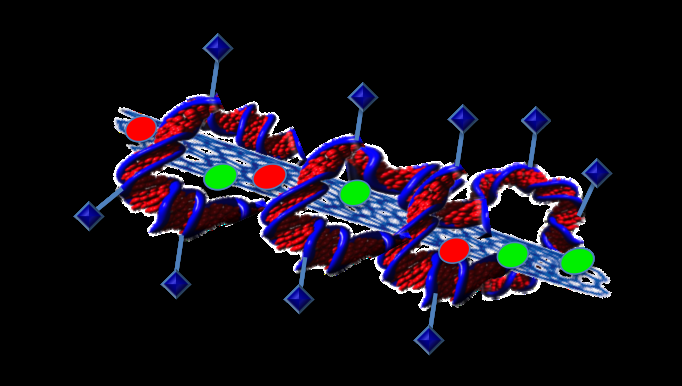
L'associazione delle proteine al DNA potrebbe creare un sistema di somministrazione dei farmaci veramente mirato. Credito:Professoressa Sonia Trigueros
Trigueros ha ora avviato test preliminari su cellule tumorali polmonari cresciute in laboratorio, ci ha detto durante un'intervista. E questo ha mostrato una promessa provvisoria, lei dice, citando dati non pubblicati sulla loro efficacia nell'uccidere queste cellule in laboratorio.
Altri sono cautamente ottimisti. "Questa è una prospettiva davvero eccitante, "dice il professor Duncan Graham, esperto di nanotecnologie e consulente di Cancer Research UK.
"A common concern with carbon nanotubes is toxicity, but when coated with DNA this concern could be removed, " lui spiega, "and it also addresses a fundamental issue, which is that they collect into clusters that become a solid mass and so are unable to leave the body."
In teoria, once Trigueros's nanotubes have finished their job they are tiny enough (50 nanometres) to be excreted through urine.
This isn't the first time carbon nanotubes have been used in cancer research:a US research team has used them, Per esempio, to target and collect images of tumours in mice. But the combination of drug delivery and cancer-specific targeting is what interests Professor Graham.
"Unlike previous work using carbon nanotubes, this approach is set to target the tumour specifically, potentially meaning fewer side effects and a lower dosage. I look forward to seeing this in animal models which is where the real proof of activity lies, " Egli ha detto.
But he's cautious, stressing that Trigueros's work has not yet been peer-reviewed and published.
Prossimi passi
Next Trigueros is aiming towards starting animal trials and, infine, she wants to begin clinical trials in patients – that is if everything goes well.
She hopes to focus on how nanostructures could be used to cross the blood-brain barrier – the brain's highly selective 'bouncer' that only lets certain molecules across. This has been notoriously difficult to get past, making targeting cancers in the brain more difficult.
But there is a still a long way to go and a lot of problems to tackle. A breve termine, we'll be keeping an eager eye on her drug delivery research, as her ideas continue to develop.