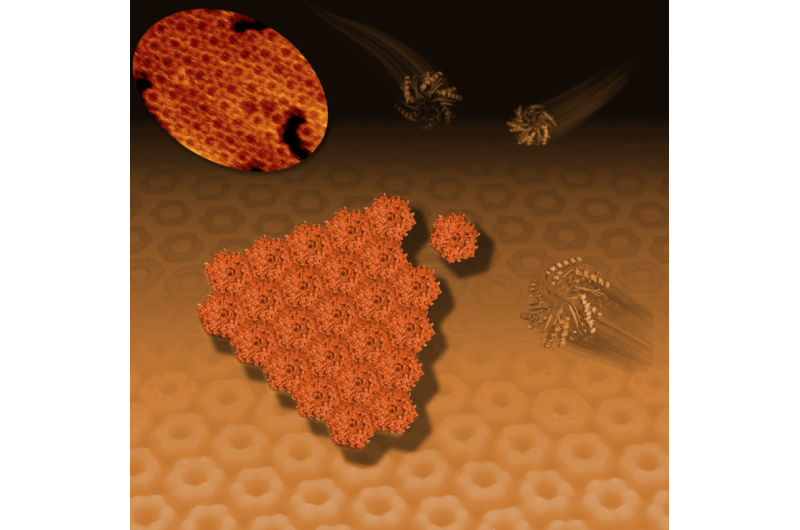
Questa illustrazione mostra come le proteine batteriche esagonali (mostrate come strutture nastriformi a destra e in alto a destra) si autoassemblano in un motivo piastrellato a nido d'ape (centro e sfondo). Questa attività di piastrellatura, visto con un microscopio a risoluzione atomica (in alto a sinistra), rappresenta la prima formazione del poliedro, strutture simili a palloni da calcio note come microcompartimenti batterici o BCM che fungono da minuscole fabbriche per una serie di attività specializzate. Credito:Berkeley Lab
Gli scienziati hanno osservato per la prima volta come le proteine batteriche si autoassemblano in fogli sottili e iniziano a formare le pareti del guscio esterno per compartimenti poliedrici di dimensioni nanometriche che funzionano come fabbriche specializzate.
La ricerca, guidato da ricercatori del Lawrence Berkeley National Laboratory (Berkeley Lab) del Dipartimento dell'Energia degli Stati Uniti e della Michigan State University in collaborazione con l'Università di Liverpool, fornisce nuovi indizi per gli scienziati che cercano di utilizzare queste strutture 3D come "nanoreattori" per aspirare selettivamente le tossine o sfornare i prodotti desiderati.
La nuova intuizione può aiutare gli scienziati che cercano di sfruttare questo origami naturale progettando nuovi compartimenti o utilizzandoli come impalcature per nuovi tipi di architetture su nanoscala, come i sistemi di somministrazione dei farmaci.
"Abbiamo un nuovo indizio per comprendere l'architettura delle cellule interne della natura, " ha detto Cheryl Kerfeld, un biologo strutturale del Berkeley Lab che è l'autore corrispondente dello studio. Il suo gruppo di ricerca al Berkeley Lab è specializzato nella struttura e nel funzionamento interno di questi minuscoli compartimenti, noti come microcompartimenti batterici o BMC. Kerfeld ha incarichi congiunti con la Divisione di Biofisica Molecolare e Bioimmagini Integrate (MBIB) del Berkeley Lab e la Michigan State University.
"Di solito riusciamo a vedere queste strutture solo dopo che si sono formate, ma in questo caso li osserviamo assemblarsi e rispondiamo ad alcune domande su come si formano, " ha detto Kerfeld. "Questa è la prima volta che qualcuno ha visualizzato l'autoassemblaggio delle sfaccettature, o lati, dei microcompartimenti. è come vedere muri, composto da piastrelle di forma esagonale, essere costruito da mani invisibili."
Lo studio è stato pubblicato online il 30 novembre in Nano lettere .
Sono stati proposti diversi modelli per come questi compartimenti sono costruiti da zero all'interno dei batteri da proteine, e c'erano molte domande aperte sul processo di costruzione.
I ricercatori hanno combinato studi a raggi X della struttura 3-D di una proteina che assomiglia a un esagono con l'imaging di un microscopio a forza atomica per rivelare come gli esagoni si dispongono in uno schema a nido d'ape nelle pareti del microscomparto.
Markus Sutter, uno scienziato del Berkeley Lab che è l'autore principale dello studio, ha determinato la struttura 3D della proteina dei mattoni di base presso l'Advanced Light Source del Berkeley Lab utilizzando campioni cristallizzati. I modelli prodotti quando i raggi X hanno colpito i cristalli proteici hanno fornito dettagli chiave sulla forma della proteina, alla scala dei singoli atomi. "Questo ci ha dato alcune dimensioni esatte, "Sutter ha detto, che ha aiutato a interpretare le immagini del microscopio. "Ci ha anche mostrato che gli esagoni avevano lati distinti:un lato è concavo, l'altro lato è convesso."
Il microscopio a forza atomica di Liverpool, BioAFM, hanno mostrato che i singoli pezzi proteici di forma esagonale si uniscono naturalmente per formare fogli proteici sempre più grandi in una soluzione liquida. Gli esagoni si assemblavano tra loro solo se avevano lo stesso orientamento:convesso con convesso o concavo con concavo.
"In qualche modo si assicurano in modo selettivo di finire con l'affrontare allo stesso modo, "Ha aggiunto Kerfeld.
Lo studio ha anche scoperto che i singoli pezzi a forma esagonale del foglio proteico possono staccarsi e spostarsi da un foglio proteico all'altro. Tali dinamiche possono consentire ai compartimenti completamente formati di riparare i singoli lati.

Markus Sutter, uno scienziato del Berkeley Lab, ha determinato la struttura atomica 3-D di una proteina batterica che si autoassembla in fogli a nido d'ape utilizzando i raggi X alla linea di luce 5.0.1 (nella foto qui) presso l'Advanced Light Source del Berkeley Lab. Credito:Roy Kaltschmidt/Berkeley Lab
I fogli proteici studiati non sono stati visualizzati all'interno di batteri viventi, sebbene le condizioni dell'esperimento al microscopio fossero progettate per imitare quelle dell'ambiente batterico naturale. "Pensiamo che questo sia ciò che accade quando questi compartimenti si assemblano all'interno del microbo, "Ha detto Kerfeld.
Alcuni studi hanno proposto che il guscio proteico dei microcompartimenti possa essere spesso più strati. Però, questo studio suggerisce che le sfaccettature del guscio sono composte da un singolo strato proteico. Sutter ha detto che questo ha senso:i compartimenti sono noti per consentire selettivamente alcuni scambi chimici tra il loro contenuto e il loro ambiente esterno, e un guscio più spesso potrebbe complicare questi scambi.
L'esatto meccanismo di questo scambio chimico non è ancora ben compreso. Si spera che questo e altri misteri dei microcompartimenti possano essere risolti con studi di follow-up che cercano di documentare l'intero processo di assemblaggio, hanno detto i ricercatori.
I microscomparti 3-D completamente formati hanno una geometria simile a un pallone da calcio che incorpora strutture proteiche a forma di pentagono note come pentameri, Per esempio, che non sono stati inclusi nell'ultimo studio.
"Il Santo Graal è vedere la struttura e la dinamica di un guscio intatto, composto da diversi tipi di proteine esagonali e con i pentagoni che ne ricoprono gli angoli, "Ha detto Kerfeld.
È possibile che la semplice aggiunta di questi pentameri ai fogli proteici dell'ultimo esperimento possa stimolare la crescita di una struttura 3D completa, ma Kerfeld ha aggiunto, "Non sarei sorpreso se ci fosse di più nella storia."
Ancora una volta si impara a conoscere i microcompartimenti, è ipotizzabile che possano essere utilizzati per concentrare la produzione di enzimi benefici, organizzarli per produrre una sequenza ordinata di reazioni chimiche, o per rimuovere particolari tossine dall'ambiente circostante, lei disse.