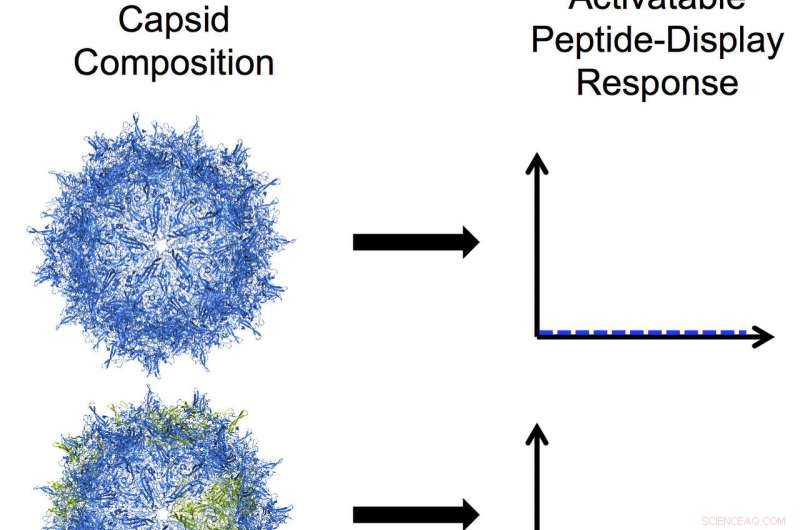
I bioingegneri della Rice University hanno sviluppato virus adeno-associati programmabili modificando una delle tre proteine che si assemblano in un guscio duro chiamato capside. In questa illustrazione, le subunità blu nel capside rappresentano la proteina VP3 e le subunità verdi rappresentano un mutante troncato di VP2. Dall'alto verso il basso:un capside solo VP3 che non mostra alcun peptide; un capside a mosaico con una maggioranza di VP3 e una piccola quantità del mutante VP2 che mostra un basso livello di visualizzazione del peptide attivabile; un capside mosaico con uguali quantità di mutante VP3 e VP2 che mostra un alto livello di visualizzazione del peptide attivabile; e un capside omomerico mutante VP2 con un alto livello di costante, display peptidico simile a un pennello. Credito:Nicole Thadani/Rice University
Intaccando una proteina virale, Gli scienziati della Rice University hanno scoperto un percorso verso virus simili, dispositivi su scala nanometrica che potrebbero essere in grado di fornire farmaci alle cellule.
La proteina è una delle tre che compongono il guscio protettivo, chiamato capside, di virus adeno-associati naturali (AAV). Creando versioni progressivamente più piccole della proteina, i ricercatori hanno realizzato capsidi con abilità uniche e hanno imparato molto sui meccanismi dell'AAV.
La ricerca appare sulla rivista American Chemical Society ACS Nano .
Il bioingegnere del riso Junghae Suh studia la manipolazione degli AAV che non causano malattie per fornire carichi utili come i farmaci chemioterapici. La sua ricerca ha portato allo sviluppo di virus che possono essere innescati dalla luce o da proteasi extracellulari associate a determinate malattie.
Gli AAV sono piccoli, circa 25 nanometri, e contengono un singolo filamento di DNA all'interno di capsidi duri che consistono in un mosaico di proteine noto come VP1, VP2 e VP3. Gli AAV sono stati utilizzati per fornire payload di terapia genica, ma nessuno ha capito come i capsidi AAV si riconfigurano fisicamente quando innescati da stimoli esterni, Suh ha detto. Quello era il punto di partenza per il suo laboratorio.
"Questo virus ha domini peptidici intrinseci (piccole proteine) nascosti all'interno del capside, " ha detto. "Quando il virus infetta una cellula, rileva il pH basso e altri fattori endosomiali, e questi domini peptidici spuntano sulla superficie del capside virale.
"Questo cambiamento conformazionale, che abbiamo chiamato "display di peptidi attivabili, ' è importante per il virus perché i domini esternalizzati rompono la membrana endosomiale e consentono al virus di fuggire nel citoplasma, " Suh ha detto. "Inoltre, le sequenze di localizzazione nucleare in quei domini consentono al virus di transitare nel nucleo. Credevamo di poter sostituire quella funzionalità con qualcos'altro".

Nicole Tadani, sinistra, e Junghae Suh della Rice University hanno sviluppato virus adeno-associati programmabili che possono essere utilizzati per somministrare farmaci peptidici. Credito:Jeff Fitlow/Rice University
Suh e l'autrice principale e studentessa laureata alla Rice, Nicole Thadani, pensano che i loro AAV mutanti possano diventare "nanoparticelle di bioinformatica" che rilevano ed elaborano gli input ambientali e producono output controllabili. La modifica del capside è il primo passo.
Delle tre proteine naturali del capside, solo VP1 e VP2 possono essere attivati per esporre i loro peptidi funzionali, ma nessuno dei due può fare da solo un capside. I VP3 più corti possono formare i capsidi da soli, ma non visualizza i peptidi. Negli AAV naturali, Le proteine VP3 sono più numerose di ciascuna delle loro compagne 10-a-1.
Ciò limita il numero di peptidi che possono essere esposti, quindi Suh, Thadani e i loro coautori si sono proposti di modificare il rapporto. Ciò li ha portati a troncare VP2 e sintetizzare capsidi a mosaico con VP3, con conseguente alterazione del numero di peptidi esposti. Sulla base di ricerche precedenti, hanno inserito un tag di esaistidina comune che ha reso facile monitorare la visualizzazione della superficie della regione del peptide.
"Volevamo aumentare la proprietà attivabile della proteina oltre a ciò che si verifica nel capside virale nativo, " ha detto Thadani. "Piuttosto che visualizzare solo cinque copie del peptide per capside, ora potremmo essere in grado di visualizzare 20 o 30 e ottenere più della bioattività che vogliamo".
Hanno quindi realizzato un VP2 troncato in grado di formare da solo un capside. "I risultati sono stati abbastanza sorprendenti, e non ovvio per noi, " Ha detto Suh. "Abbiamo abbattuto quel componente VP2 abbastanza da formare quello che chiamiamo un capside omomerico, dove l'intero capside è costituito solo da quella subunità mutante. Questo ci ha fornito virus che sembrano avere "pennelli" peptidici che sono sempre in superficie.
"Una struttura virale del genere non è mai stata vista in natura, " ha detto. "Abbiamo ottenuto una particella con questo pennello peptidico, con le estremità sciolte ovunque. Ora vogliamo sapere se possiamo usare queste estremità sciolte per attaccare altre cose o svolgere altre funzioni".
Gli AAV omomerici mostrano fino a 60 peptidi, mentre gli AAV a mosaico potrebbero essere programmati per rispondere a stimoli specifici di particolari cellule o tessuti e visualizzare un numero desiderato di peptidi più piccolo, hanno detto i ricercatori.
"I virus si sono evoluti per invadere le cellule in modo molto efficace, " Suh ha detto. "Vogliamo utilizzare il nostro virus come piattaforma di nanoparticelle per fornire terapie a base di proteine o peptidi in modo più efficiente nelle cellule. Vogliamo sfruttare ciò che la natura ha già creato, modificala un po' e usala per i nostri scopi."