Credito:Wiley
L'editing genetico è uno degli argomenti più scottanti nella ricerca sul cancro. Un team di ricerca cinese ha ora sviluppato un veicolo multifunzionale a base di nanoparticelle d'oro per trasportare le "forbici genetiche" nel genoma delle cellule tumorali. Come riportano gli autori sulla rivista Angewandte Chemie , la loro piattaforma di trasporto e rilascio non virale di sistemi di modifica genetica ha l'ulteriore vantaggio di combinare la terapia del cancro ipertermico con la modificazione genetica.
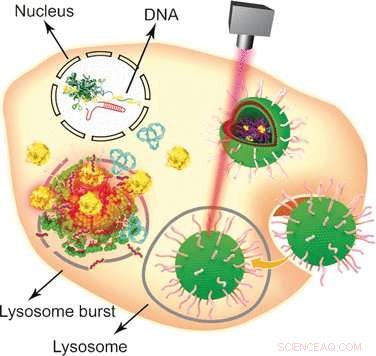
Dalla sua scoperta nel 2002, la strategia di difesa antivirale batterica CRISPR-Cas9 è emerso come uno degli approcci di ingegneria genomica più popolari con ampie applicazioni nei campi della biologia molecolare e della biomedicina. Utilizzando il sistema CRISPR-Cas9, un gene bersaglio può essere modificato, messo fuori combattimento, o inseriti in cellule eucariotiche in modo relativamente semplice e conveniente. Però, uno dei suoi punti deboli è la sua vastità, che richiede l'uso di specifici veicoli non virali per fornire il grande plasmide al nucleo. Combinando formulazioni lipidiche consolidate con nanoparticelle d'oro, Wenfu Zheng e i suoi colleghi del National Center for NanoScience and Technology, Pechino, Cina, in collaborazione con scienziati medici in Giappone e Cina, hanno trovato e testato uno strumento multifunzionale basato su componenti semplici che fornisce e rilascia efficacemente il sistema CRISPR-Cas9 nei tumori. L'irradiazione laser è stata utilizzata per smontare il veicolo lipide-nanooro dopo il suo ingresso nelle cellule tumorali e consentire l'editing del gene CRISPR-Cas9. Il knockout del gene mirato ha quindi portato all'apoptosi e all'inibizione della crescita del tumore.
Le nanoparticelle d'oro sono vettori particolarmente attraenti per varie molecole biologiche a causa della loro facile modifica, stabilità, e risposta alle radiazioni luminose. Per convertirli in un versatile veicolo biologico di trasporto e consegna, gli scienziati hanno prima attaccato i peptidi Tat, che facilitano l'attraversamento della membrana del nucleo cellulare, alle nanoparticelle d'oro. Quindi, il plasmide CRISPR-Cas9 contenente l'RNA mirato al gene Plk-1, il cui knockout comprometterebbe gravemente la funzione delle cellule tumorali, è stato attaccato ai peptidi Tat attraverso interazioni elettrostatiche in modo che rilasciassero il loro carico subito dopo essere entrati nel nucleo. Finalmente, il sistema nanoparticolare è stato rivestito con una formulazione di lipidi per migliorare l'assorbimento cellulare.
Per testare il sistema, cellule e topi portatori di tumore sono stati entrambi somministrati con il veicolo nanogold che trasporta il plasmide CRISPR-Cas9, e il rilascio della macchina per l'editing genetico è stato innescato da un laser. "In questo studio, l'irradiazione della luce ha causato il rilascio del peptide Tat dalle nanoparticelle d'oro in modo dipendente dal tempo e dall'intensità del laser, " hanno spiegato gli autori. Sono possibili anche altri approcci, come hanno sottolineato:mentre le nanoparticelle d'oro si riscaldano dopo l'irradiazione, potrebbero fungere essi stessi da agenti termoterapeutici. In sintesi, questo design relativamente semplice che comporta nanoparticelle d'oro, peptidi, e i lipidi assemblati in un sofisticato sistema multifunzionale di trasporto/rilascio potrebbero fungere da piattaforma di somministrazione multifunzionale per vari aspetti della terapia genica.