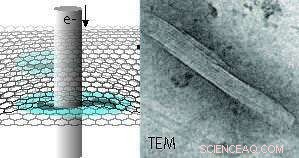
Rappresentazione schematica delle proteine dei microtubuli idratati incapsulate tra due strati di grafene ripresi mediante microscopia elettronica a trasmissione (TEM). Un esempio di immagine TEM di un microtubulo è mostrato a destra Il rivestimento interno riflette la struttura del protofilamento del microtubulo polimerico. Gratuito all'interno di questo comunicato stampa. Credito:INM, Niels de Jonge
La microscopia elettronica è uno dei principali metodi utilizzati per esaminare la struttura delle proteine. Lo studio di queste strutture è di fondamentale importanza per chiarire la loro funzione fornendo informazioni fondamentali in una serie di campi come la biologia strutturale, biologia cellulare, ricerca sul cancro, e altri campi biomedici. Migliora anche la comprensione della biomineralizzazione.
Una nuova opzione per l'imaging delle proteine è la microscopia elettronica in fase liquida (LPEM), che è in grado di visualizzare la struttura proteica nativa (non colorata) e altri campioni come nanomateriali o cellule in un liquido. Questa tecnologia è stata sviluppata negli ultimi quindici anni. Fino a poco tempo fa, ha discusso se la tolleranza alle radiazioni dei campioni liquidi sarebbe stata migliore o peggiore rispetto al ghiaccio amorfo. Nella loro recente pubblicazione, Sercan Keskin e Niels de Jonge dell'INM-Leibniz Institute for New Materials ora dimostrano, che la tolleranza alle radiazioni è aumentata di un ordine di grandezza rispetto a un campione nel ghiaccio. Questo risultato è stato ottenuto preparando un campione di microtubuli in una cella liquida di grafene. Essenziale era usare una velocità il più bassa possibile a cui è stata applicata l'irradiazione del fascio di elettroni.
Tradizionalmente, i campioni sono stati fissati, tinto con un metallo per migliorare il loro contrasto, successivamente essiccato, incastonato nella plastica, tagliato in sezioni sottili, e quindi ripreso nell'ambiente sotto vuoto richiesto per la microscopia elettronica. La criomicroscopia elettronica supera gli svantaggi associati a questa preparazione del campione e fornisce i mezzi per studiare le proteine in uno stato idrato vicino allo stato nativo preparandole in ghiaccio amorfo. Però, un'imitazione chiave è l'elevata sensibilità dei campioni all'irradiazione del fascio di elettroni, in modo che il rumore statistico nell'immagine impedisca l'alta risoluzione e molte decine di migliaia di immagini rumorose di strutture identiche devono essere riprese per risolvere la struttura.