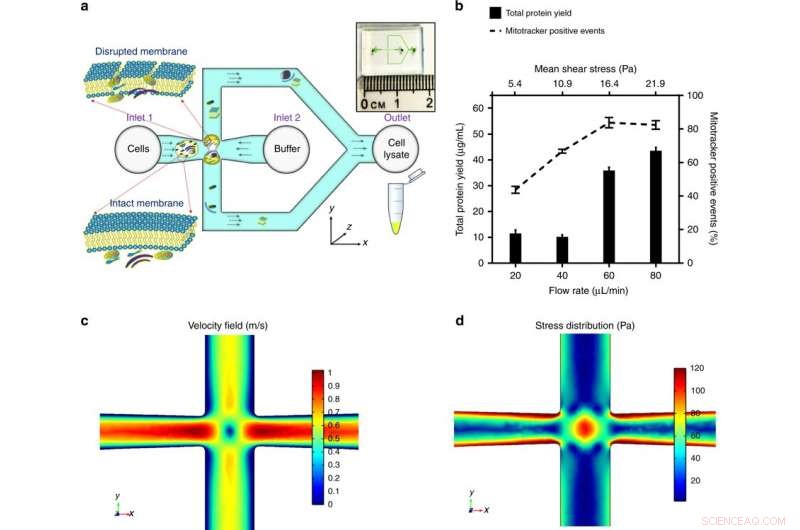
a) Le cellule vengono introdotte nella giunzione incrociata del microcanale. Lo stress applicato sulla cellula è ottimizzato per distruggere la membrana cellulare e rilasciare componenti subcellulari, mantenendo l'integrità dei mitocondri. La panoramica del chip microfluidico è mostrata nel riquadro. b) La tensione media applicata, modulata controllando la portata volumetrica per una data geometria del canale, è stato ottimizzato dalla massima resa proteica (un'indicazione della quantità dei contenuti subcellulari estratti) e dai massimi eventi positivi al mitotracker (un segno distintivo dei mitocondri funzionali). I risultati sono stati ottenuti triturando le cellule HEK293 (cellule renali embrionali, 106 cellule/mL) da un intervallo di stress da taglio e tracciato come mediaα SD (n = 3 esperimenti indipendenti). COMSOL Multiphysics® ha stabilito un modello di simulazione agli elementi finiti per illustrare il flusso fluidico alla giunzione incrociata. Dare una portata volumetrica a 60 µl/min, c) illustra il profilo di velocità e il punto di ristagno al centro (dove la velocità del flusso è zero), e d) illustra la distribuzione delle sollecitazioni e i campi di flusso estensionale attorno al punto di ristagno, che contribuisce in modo significativo alla deformazione e distruzione cellulare. Credito:Microsistemi e nanoingegneria, doi:https://doi.org/10.1038/s41378-018-0037-y.
I mitocondri sono dinamici, organelli intracellulari bioenergetici, responsabile della produzione di energia tramite la produzione di ATP durante la respirazione. Sono coinvolti in attività metaboliche cellulari chiave che regolano le risposte fisiologiche vitali delle cellule, compresa la segnalazione cellulare, differenziazione cellulare e morte cellulare. I mitocondri difettosi sono collegati a diverse malattie genetiche umane critiche, comprese le malattie neurodegenerative, cancro e malattie cardiovascolari.
La caratterizzazione dettagliata dei mitocondri funzionali rimane relativamente inesplorata a causa della mancanza di metodi efficaci di estrazione degli organelli. Ad esempio, il processo di estrazione deve sostenere una funzionalità sufficiente degli organelli ex vivo per illuminare le loro funzioni citosoliche in presenza di citoscheletro e altri organelli subcellulari. Poiché i mitocondri crescono in una complessa rete reticolare all'interno delle cellule per subire alterazioni strutturali, la loro caratterizzazione intracellulare è ulteriormente complicata. Di conseguenza, l'analisi in vitro dei mitocondri rimane il metodo principale, estrarre separatamente e comprendere le proprietà intrinseche dei mitocondri, senza l'interferenza di altri organelli subcellulari.
In un recente studio, ora pubblicato in Microsistemi e nanoingegneria , Habibur Rahman e colleghi del Dipartimento di ingegneria biomedica hanno esplorato la possibilità di controllare lo stress idrodinamico per un'estrazione mitocondriale efficiente. Per questo, hanno usato la geometria microfluidica a giunzione incrociata su microscala per distruggere selettivamente la membrana cellulare, garantendo nel contempo l'integrità della membrana mitocondriale.
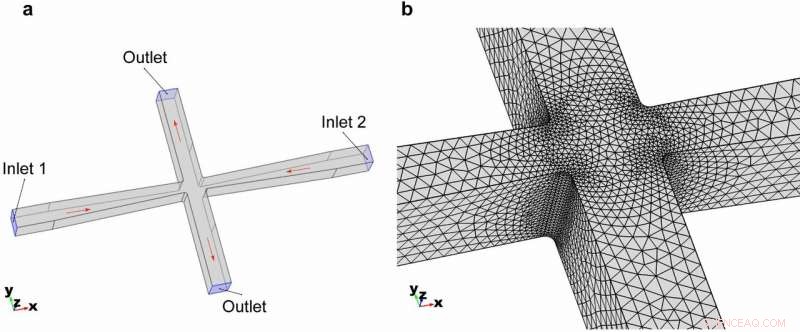
Geometria 3D del canale di microfluidica cross-slot. (a) Geometria complessiva e condizioni al contorno del modello. (b) Meshing degli elementi ingranditi nella regione dello slot incrociato. Credito:Microsistemi e nanoingegneria, doi:https://doi.org/10.1038/s41378-018-0037-y
I progressi nella microfluidica hanno dimostrato i vantaggi delle procedure di laboratorio su chip con dimensioni del campione significativamente ridotte e una maggiore riproducibilità sperimentale. Lo stress idrodinamico prodotto nei chip microfluidici può essere utilizzato per aprire transitoriamente le membrane cellulari o nucleari durante la consegna genica intracellulare. Il potenziale di tali tecniche è stato raramente esaminato per l'estrazione di organelli subcellulari poiché le geometrie vincolate dei microcanali possono causare l'intasamento dei componenti subcellulari nelle micromacchine.
Gli autori hanno ottimizzato le condizioni sperimentali di funzionamento sulla base di studi precedenti per distruggere efficacemente le membrane cellulari mantenendo i mitocondri intatti nelle linee cellulari di mammifero modello. Le linee cellulari modello di interesse erano cellule renali embrionali umane (HEK293), cellule muscolari di topo (C2C12) e cellule di neuroblastoma (SH-SY5Y).
Nel principio di funzionamento del trituratore cellulare proposto su microscala, gli scienziati hanno misurato la differenza nel modulo elastico tra la membrana mitocondriale e la membrana cellulare per distruggere la cellula pur mantenendo la membrana mitocondriale. Un aumento del livello di stress nel sistema potrebbe distruggere le membrane cellulari con moduli elastici più elevati (come visto con la linea cellulare del neuroblastoma). Lo studio ha confrontato la resa proteica e la concentrazione dei mitocondri funzionali estratti utilizzando il metodo proposto rispetto ai kit disponibili in commercio per una gamma di concentrazioni cellulari.
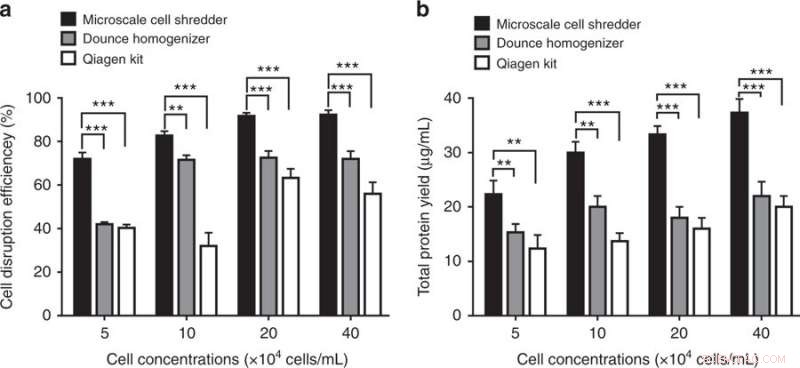
Efficienza di distruzione cellulare ed estrazione di proteine utilizzando il trituratore cellulare su microscala, l'omogeneizzatore Dounce e il kit di isolamento dei mitocondri Qiagen. a) Efficienza di distruzione cellulare, determinato dalla frazione di cellule distrutte rispetto al numero totale di cellule intatte, è stata quantificata a diverse concentrazioni di cellule. b) Dopo le fasi di centrifugazione, la resa proteica totale è stata determinata di conseguenza. Questi esperimenti sono stati condotti utilizzando cellule HEK293. I risultati sono stati tracciati come mediaα SD (n = 3 esperimenti indipendenti, **P < 0.01, ***P < 0,001). Credito:Microsistemi e nanoingegneria, doi:https://doi.org/10.1038/s41378-018-0037-y.
I risultati hanno mostrato che il metodo di triturazione cellulare proposto su microscala era più efficiente dei kit commerciali producendo circa il 40% in più di mitocondri funzionali. Gli scienziati sono stati in grado di preservare l'integrità strutturale degli organelli estratti anche a basse concentrazioni cellulari. Il metodo è in grado di elaborare rapidamente una quantità limitata di campioni (200 µl).
I risultati dettagliati sono stati la prima dimostrazione in studio dell'estrazione di mitocondri intatti e funzionali utilizzando lo stress idrodinamico su microscala. La possibilità di elaborare una bassa concentrazione e una piccola dimensione del campione è favorevole per le indagini cliniche sulla malattia mitocondriale. Per testare la sollecitazione esercitata dalla giunzione incrociata progettata, hanno utilizzato prima un modello di simulazione COMSOL Multiphysics. Successivamente, Rahman et al. determinato sperimentalmente la portata volumetrica per tre linee cellulari modello. Durante la distruzione sperimentale della membrana cellulare, sotto sforzo di taglio medio (16,4 Pa, per una portata di 60 µl/min), gli organelli subcellulari sono stati rilasciati e rilevati con un aumento dei segnali positivi mitocondriali.
Gli scienziati hanno confrontato la capacità del trituratore cellulare miniaturizzato con quella di due kit commerciali:l'omogeneizzatore Dounce (metodo meccanico di distruzione cellulare) e il kit di isolamento dei mitocondri Qproteome (metodo chimico di distruzione cellulare) per estrarre i mitocondri. Per determinare il numero di mitocondri funzionali estratti, gli scienziati hanno utilizzato MitoTracker, un colorante fluorescente che colora i mitocondri durante l'analisi citometrica a flusso. I risultati hanno mostrato che il trituratore di cellule su microscala è stato in grado di estrarre il 40% in più di mitocondri funzionali rispetto ai kit commerciali per le cellule HEK 293 e C2C12.
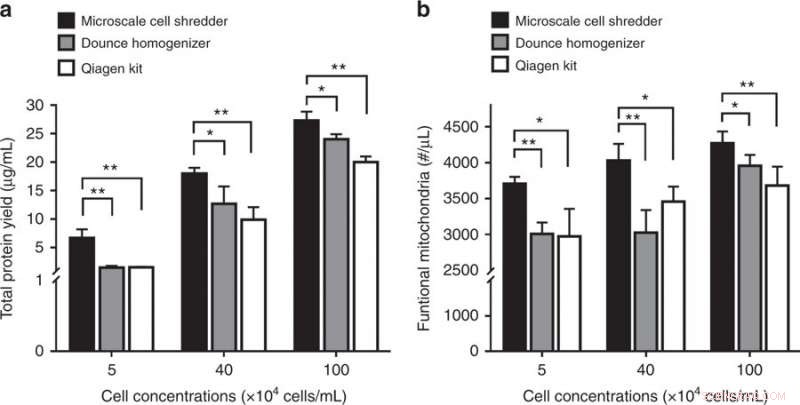
Interruzione delle cellule di neuroblastoma (SH-SY5Y) e successiva estrazione mitocondriale. a Resa proteica totale e b concentrazioni di mitocondri funzionali ottenuti dai tre metodi di estrazione. I risultati sono stati tracciati come mediaα SD (n = 3 esperimenti indipendenti, *P < 0.05, **P < 0,01). Credito:Microsistemi e nanoingegneria, doi:https://doi.org/10.1038/s41378-018-0037-y.
Rahman et al. condotto il saggio citrato sintasi per determinare l'integrità mitocondriale attraverso l'attività enzimatica dei mitocondri danneggiati. Come prima, rispetto ai kit commerciali, l'integrità mitocondriale era maggiore per quelli estratti utilizzando il trituratore su microscala nelle cellule HEK293 e C2C12.
Lo studio ha dimostrato l'importanza della rigidità della membrana convalidando il concetto proposto di distruggere le membrane cellulari del neuroblastoma (SH-SY5Y). Poiché la membrana cellulare SH-SY5Y aveva un modulo elastico più elevato rispetto a entrambe le linee cellulari HEK293 e C2C12, gli scienziati hanno dovuto ottimizzare la portata volumetrica nel trituratore su microscala per distruggere efficacemente le membrane cellulari SH-SY5Y. Ancora, rispetto alle estrazioni di kit commerciali, l'utilizzo del metodo proposto ha fornito una concentrazione significativamente più elevata di proteine e mitocondri funzionali per la linea cellulare di interesse.

Una sezione di strozzatura è inclusa nel design del canale del trituratore di cellule su microscala per garantire che le cellule siano focalizzate lateralmente al centro del flusso di flusso nel bioreattore a microfluidica. Credito:Microsistemi e nanoingegneria, doi:https://doi.org/10.1038/s41378-018-0037-y
In questo modo, Rahman et al. ha studiato la possibilità di distruggere la membrana cellulare per mantenere l'integrità delle membrane mitocondriali in diverse linee cellulari modello di mammifero. Hanno determinato lo stress estensionale ottimale e la portata all'interno di un bioreattore a sezione trasversale microfluidica, basato sul modulo di Young della linea cellulare modello di interesse. Durante la progettazione del canale, gli scienziati hanno incluso una sezione di strozzatura nel bioreattore microfluidico prodotto utilizzando la litografia morbida.
Il trituratore di cellule microfluidico proposto ha dimostrato una capacità superiore di estrarre mitocondri e proteine funzionali controllando per la prima volta lo stress idrodinamico, rispetto ai kit di estrazione di organelli cellulari disponibili in commercio. Gli esperimenti sono stati fattibili anche con quantità minime di campioni (200 µl di volume, contenente 10 4 cellule/mL) per potenziali applicazioni cliniche. Rahman et al. sono stati in grado di replicare fedelmente il protocollo su tre linee cellulari. Il lavoro sperimentale può essere tradotto in un contesto clinico per comprendere in profondità i disturbi correlati alla disfunzione mitocondriale.
© 2019 Scienza X Rete