
Immagine degli impianti chirurgici, ricoperti di nanoparticelle d'oro (pila di maglie a sinistra) rispetto alle maglie chirurgiche originali prima del trattamento (pila di maglie a destra). Credito:ICFO
Inventato circa 50 anni fa, le reti mediche chirurgiche sono diventate elementi chiave nelle procedure di recupero degli interventi chirurgici sui tessuti danneggiati, il più frequente è la riparazione dell'ernia. Quando impiantato all'interno del tessuto del paziente, il design flessibile e conformabile di queste reti aiuta a tenere i muscoli tesi e consente ai pazienti di recuperare molto più velocemente rispetto alla chirurgia convenzionale di semina e cucitura.
Però, l'inserimento di un impianto medico nel corpo di un paziente comporta il rischio di contaminazione batterica durante l'intervento chirurgico e la successiva formazione di un biofilm infettivo sulla superficie della rete chirurgica. Tali biofilm tendono ad agire come un rivestimento impermeabile, impedendo a qualsiasi tipo di agente antibiotico di raggiungere e attaccare i batteri formati sul film per fermare l'infezione. Così, terapie antibiotiche, che sono a tempo limitato, potrebbe fallire contro questi batteri super resistenti e il paziente potrebbe finire in interventi chirurgici ricorrenti che potrebbero anche portare alla morte. Infatti, secondo la rete europea di sorveglianza della resistenza antimicrobica (EARS-Net), nel 2015 più di 30, 000 decessi in Europa sono stati collegati a infezioni da batteri resistenti agli antibiotici.
Nel passato, sono stati cercati diversi approcci per prevenire la contaminazione dell'impianto durante l'intervento chirurgico. Sono stati stabiliti e implementati protocolli asettici post-operatori per combattere questi batteri resistenti agli antibiotici, ma nessuno ha svolto completamente il ruolo di risolvere questo problema.
In un recente studio pubblicato su Nano lettere ed evidenziato in Fotonica della natura , I ricercatori ICFO Dr. Ignacio de Miguel, Arantxa Albornoz, guidato dal Prof. ICREA presso ICFO Romain Quidant, in collaborazione con la ricercatrice Irene Prieto, Dott.ssa Vanesa Sanz, Dr. Christine Weis e Dr. Pau Turon della principale azienda di dispositivi medici e dispositivi farmaceutici B. Braun, hanno ideato una nuova tecnica che utilizza la nanotecnologia e la fotonica per migliorare notevolmente le prestazioni delle reti mediche per gli impianti chirurgici.
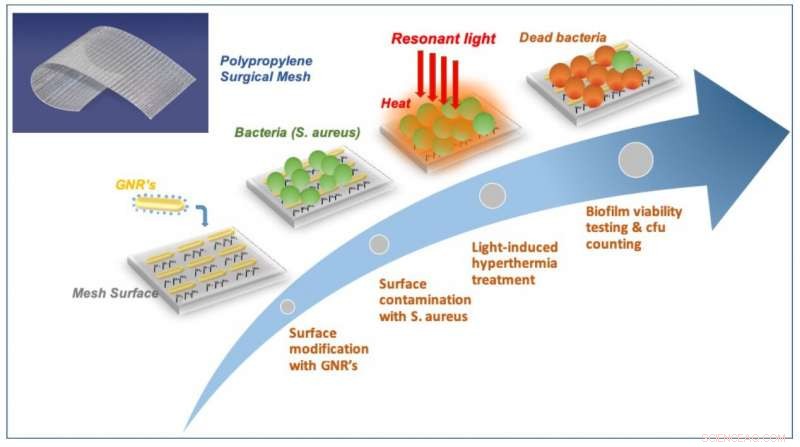
Attraverso una collaborazione in corso dal 2012, il team di ricercatori dell'ICFO e B. Braun Surgical, S.A., ha sviluppato una rete medica con una caratteristica particolare:la superficie della rete è stata modificata chimicamente per ancorare milioni di nanoparticelle d'oro. Come mai? Perché è stato dimostrato che le nanoparticelle d'oro convertono in modo molto efficiente la luce in calore in regioni molto localizzate.

Micrografie SEM del S. aureus biofilm formato sulla superficie della rete chirurgica. Credito:ICFO
La tecnica dell'utilizzo di nanoparticelle d'oro nei processi di conversione luce-calore era già stata testata nei trattamenti contro il cancro in studi precedenti. Ancora di più, all'ICFO questa tecnica era stata implementata in diversi studi precedenti supportati dalla Fondazione Cellex, rappresentando così un altro esempio saliente di come il primo sostegno filantropico visionario indirizzato ad affrontare problemi fondamentali porta alla fine a importanti applicazioni pratiche. Per questo caso particolare, sapendo che ogni anno in tutto il mondo vengono eseguiti più di 20 milioni di interventi di riparazione dell'ernia, credevano che questo metodo potesse ridurre i costi medici nelle operazioni ricorrenti eliminando i trattamenti antibiotici costosi e inefficaci attualmente impiegati per affrontare questo problema.
Così, nel loro esperimento in vitro e attraverso un processo approfondito, il team ha rivestito la rete chirurgica con milioni di nanoparticelle d'oro, distribuendoli uniformemente su tutta la struttura. Hanno testato le maglie per garantire la stabilità a lungo termine delle particelle, la non degradazione del materiale, e il non distacco o rilascio di nanoparticelle nell'ambiente circostante (flask). Sono stati in grado di osservare una distribuzione omogenea delle nanoparticelle sulla struttura utilizzando un microscopio elettronico a scansione.
Vista schematica della prevenzione del biofilm attivato dal plasmone su reti chirurgiche. Credito:ICFO
Una volta che la mesh modificata era pronta, il team lo ha esposto ai batteri S.aureus per 24 ore fino a quando non hanno osservato la formazione di un biofilm sulla superficie. Successivamente, hanno iniziato a esporre la rete a brevi impulsi intensi di luce nel vicino infrarosso (800 nm) per 30 secondi per garantire il raggiungimento dell'equilibrio termico, prima di ripetere questo trattamento 20 volte con intervalli di 4 secondi tra ogni impulso. Hanno scoperto quanto segue:in primo luogo, hanno visto che illuminare la maglia alla frequenza specifica avrebbe indotto risonanze plasmoniche superficiali localizzate nelle nanoparticelle, una modalità che si traduce nella conversione efficiente della luce in calore, bruciando i batteri in superficie. In secondo luogo, utilizzando un microscopio confocale a fluorescenza, hanno visto quanti dei batteri erano morti o erano ancora vivi. Per i batteri rimasti in vita, hanno osservato che i batteri del biofilm sono diventati cellule planctoniche, recuperare la loro sensibilità o debolezza nei confronti della terapia antibiotica e della risposta del sistema immunitario. Per i batteri morti, hanno osservato che aumentando la quantità di luce trasmessa alla superficie della rete, i batteri perderebbero la loro aderenza e si staccherebbero dalla superficie. In terzo luogo, hanno confermato che il funzionamento a raggi di luce dell'infrarosso vicino era completamente compatibile con le impostazioni in vivo, il che significa che una tale tecnica molto probabilmente non danneggerebbe il tessuto sano circostante. Finalmente, hanno ripetuto il trattamento e hanno confermato che il riscaldamento ricorrente della rete non aveva influito sulle sue capacità di efficienza di conversione.
Come commenta il Prof di ICREA presso ICFO Romain Quidant, "i risultati di questo studio hanno aperto la strada all'utilizzo delle nanotecnologie plasmoniche per prevenire la formazione di biofilm batterico sulla superficie degli impianti chirurgici. Ci sono ancora diverse questioni che devono essere affrontate, ma è importante sottolineare che tale tecnica sarà davvero significare un cambiamento radicale nelle procedure operative e un ulteriore recupero del paziente".
Dott. Pau Turon, Direttore della Ricerca e Sviluppo presso B. Braun Surgical, S.A. spiega, "Il nostro impegno per aiutare gli operatori sanitari a evitare le infezioni ospedaliere ci spinge a sviluppare nuove strategie per combattere batteri e biofilm. Inoltre, il team di ricerca sta esplorando l'estensione di tale tecnologia ad altri settori in cui i biofilm devono essere evitati".