
Le microcapsule con gusci di spessore variabile (rosso) possono incapsulare stabilmente il carico e rilasciarlo in modo calibrato con precisione, bassa pressione osmotica, consentendo la consegna sicura di farmaci e altre sostanze all'interno del corpo umano. Credito:Wyss Institute presso l'Università di Harvard
Rompere un uovo per rilasciare il tuorlo richiede l'applicazione di una forza esterna (come essere sbattuti contro il bordo di una ciotola) per superare la forza del guscio d'uovo. Allo stesso modo, la somministrazione di biomolecole terapeutiche contenenti microcapsule nel corpo umano richiede che i loro contenitori vengano rotti dopo essere stati iniettati, in modo che il carico possa essere consegnato nel posto giusto al momento giusto. Una serie di stimoli esterni può essere utilizzata per innescare il rilascio di molecole incapsulate, uno dei più facili dei quali è la pressione osmotica, in quanto richiede semplicemente l'introduzione di acqua per far gonfiare e scoppiare le microcapsule. Però, per creare una pressione interna sufficiente a rompere il guscio della capsula, grandi quantità di un agente osmotico devono essere aggiunte alla microcapsula per attirare l'acqua, e l'elevata pressione di scoppio risultante potrebbe danneggiare i tessuti o causare coaguli di sangue.
Una soluzione a questo ostacolo è stata ora sviluppata dai ricercatori del Wyss Institute for Biologically Inspired Engineering di Harvard e della John A. Paulson School of Engineering and Applied Sciences (SEAS), che ha ideato un modo per creare microcapsule con gusci di spessore irregolare che consentono loro di scoppiare a pressioni osmotiche inferiori, rendendoli più sicuri per l'uso nel corpo umano. La ricerca è pubblicata su Piccolo .
"La parte più debole dei nostri proiettili è 40 volte più sottile della loro parte più forte, che rende molto più facile per loro rompere e rilasciare il carico, " ha detto il primo autore Weixia Zhang, dottorato di ricerca, un Postdoctoral Fellow presso il Wyss Institute e SEAS. "Il rovescio della medaglia, queste microcapsule sono estremamente resistenti e non perdono se non sono esposte a una pressione osmotica elevata, rendendoli molto stabili e capaci di conservare a lungo il loro contenuto."
Per fabbricare le loro microcapsule disomogenee, i ricercatori hanno utilizzato un dispositivo microfluidico capillare di vetro che impiegava un metodo acqua-in-olio-in-acqua per incapsulare una soluzione acquosa contenente saccarosio, un agente osmotico, all'interno di un guscio di monomeri sospesi nell'olio. Quando i monomeri sono esposti alla luce UV, reagiscono tra loro e si reticolano per formare un solido, guscio polimerico attorno alla soluzione di saccarosio. Variando le velocità con cui la soluzione di saccarosio "carico" e il "guscio" di olio monomero fluiscono attraverso il dispositivo, il team ha scoperto che potevano introdurre variazioni nello spessore dei gusci che si erano formati, creando capsule sbilenche con pareti più spesse da un lato e più sottili dall'altro.
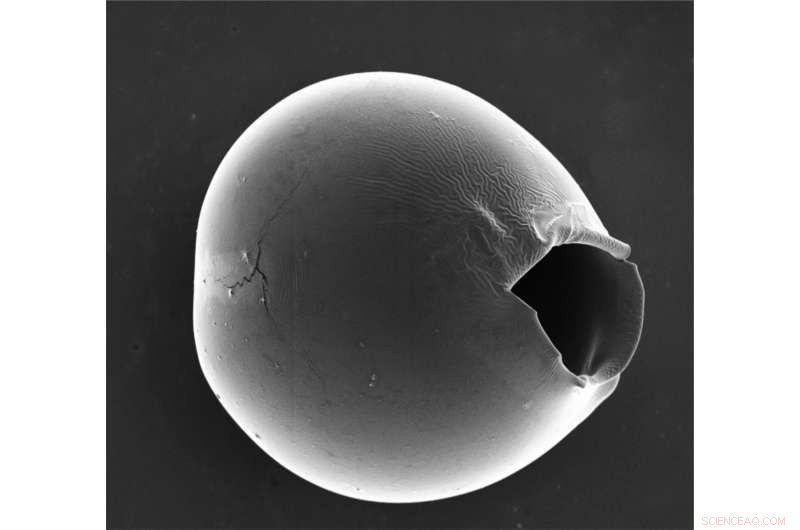
Le microcapsule scoppiano nella parte più sottile del guscio, lasciando un'apertura di decine di micron che consente il rilascio della maggior parte delle biomolecole e dei farmaci. Credito:Wyss Institute presso l'Università di Harvard
I ricercatori hanno poi sottoposto le loro microcapsule a shock osmotico aggiungendo acqua, che si diffondeva nelle microcapsule e le faceva iniziare a gonfiarsi nella parte più sottile del guscio. Dopo circa 20-30 minuti, il guscio assottigliato si ruppe, formando un'apertura di decine di micrometri, che è abbastanza grande da consentire il rilascio con successo della maggior parte delle biomolecole e dei nanomateriali. L'aumento della differenza tra la parte più sottile e quella più spessa del guscio ha portato a un maggior numero di microcapsule scoppiate, confermando che il grado di disomogeneità ha influito sull'efficacia del rilascio del carico.
"Essere in grado di creare microcapsule con un alto grado di disomogeneità alterando lo spessore del guscio durante il processo di fabbricazione e rilasciare il carico con una pressione osmotica molto più piccola apre una nuova applicazione nel rilascio controllato, che è molto importante per la somministrazione di farmaci in medicina, così come altri campi, " ha detto il co-primo autore Liangliang Qu, dottorato di ricerca, un Postdoctoral Fellow presso il Wyss Institute e SEAS.
Per testare la durata delle microcapsule, il team ha incapsulato un polimero fluorescente al loro interno e ha misurato il cambiamento dell'intensità fluorescente nei loro nuclei nel tempo. Non hanno osservato alcun cambiamento di intensità per 30 giorni dopo l'incapsulamento, dimostrando che le microcapsule hanno trattenuto il loro carico senza perdite. Per di più, la dimensione del polimero è molto più piccola della maggior parte delle biomolecole, come anticorpi ed enzimi, suggerendo che i gusci potrebbero essere utilizzati per proteggere e conservare biomolecole o farmaci per lunghi periodi di tempo.
Finalmente, i ricercatori hanno co-incapsulato una proteasi (un enzima che scompone le proteine) e saccarosio all'interno delle loro microcapsule per 37 giorni, quindi applicato uno shock osmotico per innescare il rilascio del loro contenuto. La proteasi ha mantenuto il 91% della sua attività originale, dimostrando che questo metodo di conservazione non ha compromesso in modo significativo la sua funzione biologica.
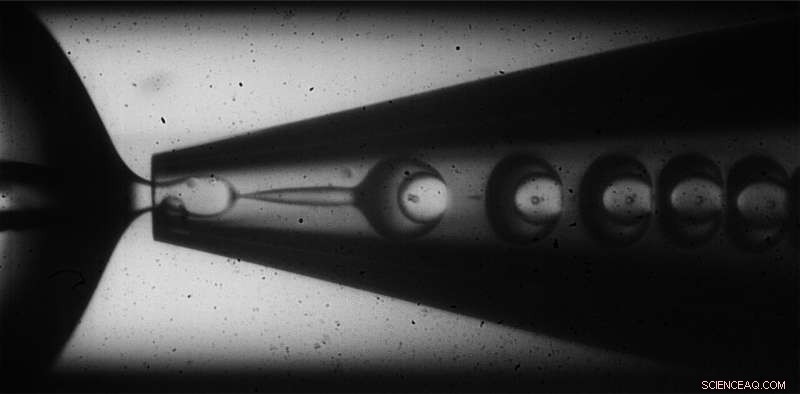
Le microcapsule vengono create utilizzando una tecnica olio-in-acqua-in-olio che raggiunge uno spessore del guscio disomogeneo variando le portate del guscio e dei materiali del carico. Credito:Wyss Institute presso l'Università di Harvard
"Rispetto ad altri vettori a rilascio controllato, come le cellule, nanoparticelle, o vescicole, questo sistema è altamente versatile, stabile, e personalizzabile, rendendolo un'alternativa interessante per la somministrazione sicura ed efficace di farmaci e altre biomolecole per la salute umana e altre applicazioni, " ha detto l'autore corrispondente David Weitz, dottorato di ricerca, un membro della facoltà principale presso il Wyss Institute che è anche professore di fisica e fisica applicata di Mallinckrodt presso SEAS.
Il team sta continuando a sviluppare le loro microcapsule ottimizzando il materiale del guscio per ridurre ulteriormente la pressione osmotica necessaria per romperle. Hanno in programma di applicare prima la loro tecnologia alla somministrazione di farmaci, come anticorpi terapeutici, con l'obiettivo di poter utilizzare l'alto contenuto di acqua del corpo umano per agire come innesco di rottura dopo l'iniezione.
"Questo progetto è un ottimo esempio di come soluzioni più semplici spesso possono essere migliori di quelle complicate, poiché l'unico input necessario per far scoppiare le microcapsule è la pressione meccanica, piuttosto che chimiche complesse o interruttori molecolari, " ha detto il co-autore Donald Ingber, M.D., dottorato di ricerca, chi è il direttore fondatore del Wyss Institute, il Judah Folkman Professor of Vascular Biology presso HMS e il Vascular Biology Program presso il Boston Children's Hospital, e Professore di Bioingegneria presso SEAS.