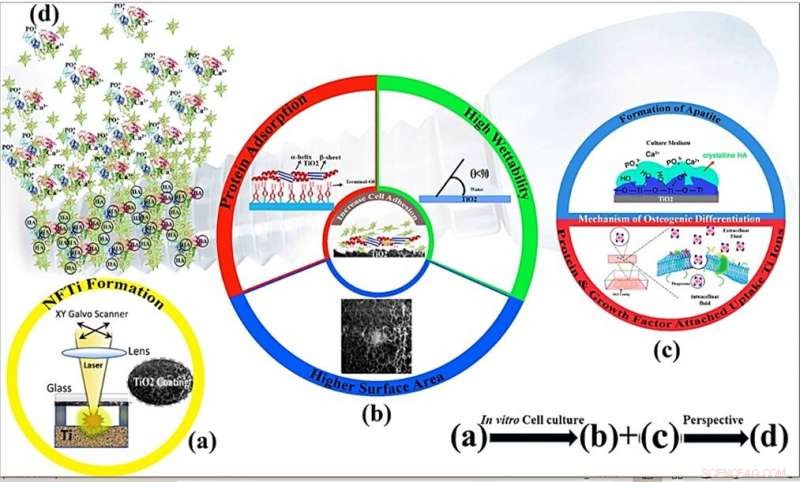
Meccanismi schematici della proliferazione cellulare e dell'osteoinduttività del rivestimento in titanio nanofibroso mediante modifica della superficie mediante trasferimento inverso indotto da laser ad alta intensità (HILIRT):un nuovo metodo di deposizione. (a) Strato NFTi depositato su vetro mediante la tecnica HILIRT proposta a velocità di scansione del raggio laser. (b) La biocompatibilità del titanio come materiale da impianto è attribuita all'ossido superficiale che si forma spontaneamente nell'aria e/o nei fluidi fisiologici, e si ritiene che i comportamenti cellulari, per esempio., adesione, la diffusione e la proliferazione sono fortemente influenzate da 1. Area superficiale 2. bagnabilità 3. gruppi ossidrilici di superficie (I gruppi ossidrilici di superficie del terminale OH- regolano i comportamenti iniziali di adsorbimento delle proteine). (c) I gruppi idrossilici di superficie e le nanoparticelle di Ti bioattive promuovono la differenziazione degli osteoblasti attraverso 1. I gruppi Ti-OH formati sulla superficie del titanato dopo l'immersione nel mezzo di coltura osteogenica sono caricati negativamente, e quindi si combinano selettivamente con gli ioni Ca2+ caricati positivamente nel fluido per formare eventualmente fosfato di calcio. 2. Biocomplessi (ioni, proteina e fattore di crescita) sono internalizzati da endocitosi mediata da caveole. (d) Prospettiva:Formazione ossea e rimodellamento attorno ai materiali impiantati. Credito:rapporti scientifici, doi:10.1038/s41598-019-54533-z
In un nuovo studio pubblicato su Rapporti scientifici , Mohammad-Hossein Beigi e un team di ricerca nei dipartimenti di ingegneria e scienze applicate e biotecnologia cellulare in Canada e Iran hanno descritto un nuovo metodo per formare biomateriali biocompatibili per l'ingegneria del tessuto osseo. Hanno progettato come il web, rivestimenti nanofibrosi tridimensionali (3-D) in Titania mediante trasferimento inverso indotto da laser ad alta intensità (HILIRT). Il team ha prima dimostrato il meccanismo di ablazione e deposizione di titanio (Ti) su substrati di vetro utilizzando più impulsi laser a picosecondi nell'aria ambiente per confrontare le previsioni teoriche con i risultati sperimentali. Hanno esaminato le prestazioni dei campioni di vetro sviluppati rivestendo strutture nanofibrose di titanio attraverso varie durate di impulsi laser, utilizzando metodi come la microscopia elettronica a scansione (SEM).
Per comprendere le interazioni tra la nuova superficie del materiale e le cellule biologiche, Beigi et al. ha esplorato le interazioni delle cellule staminali mesenchimali derivate dall'osso umano (BMSCs) coltivate sui nuovi biomateriali. Per questo, hanno utilizzato una varietà di test in laboratorio tra cui un metodo colorimetrico per comprendere l'attività metabolica cellulare (saggio MTS), immunocitochimica, analisi di adsorbimento e assorbimento di proteine. I risultati hanno mostrato una biocompatibilità significativamente migliorata nei campioni trattati con il laser rispetto ai substrati non trattati. Beigi et al. hanno modificato la loro tecnica HILIRT diminuendo la durata dell'impulso e generando nanofibre di titania con strutture più dense durante l'ingegneria dei materiali avanzati. Secondo le loro scoperte, la densità delle nanostrutture e la concentrazione delle nanofibre rivestite hanno svolto un ruolo fondamentale per generare bioattività nei campioni trattati inducendo la differenziazione precoce delle BMSCs (cellule staminali mesenchimali derivate dall'osso) per formare tessuto osseo tramite differenziazione osteogenica (formazione ossea).
I bioingegneri stanno sviluppando rapidamente nuove tecniche di ingegneria del tessuto osseo (BTE) per la rigenerazione ossea; migliorare gli attuali "standard aurei" dei metodi di innesto osseo autologo e alloinnesto nella medicina rigenerativa. Gli svantaggi delle tecniche esistenti includono la morbilità del sito donatore e supplementi di nutrienti limitati durante la rigenerazione ossea. L'ingegneria del tessuto osseo (BTE) è una direzione di ricerca promettente per facilitare la crescita e la riparazione ossea, anche in difetti scheletrici su larga scala. I ricercatori mirano a utilizzare le cellule staminali con BTE grazie alle loro capacità di autorinnovamento insieme alla differenziazione delle cellule staminali, per formare una varietà di tipi di tessuto. Poiché le proprietà fisiche e chimiche della superficie di un materiale possono influenzare la vitalità delle cellule staminali mesenchimali umane (hMSC) per l'autorigenerazione, differenziazione e proliferazione. I materiali e le cellule possono quindi lavorare insieme nelle applicazioni di BTE per fornire una piattaforma desiderata per l'osteointegrazione durante il rimodellamento osseo.
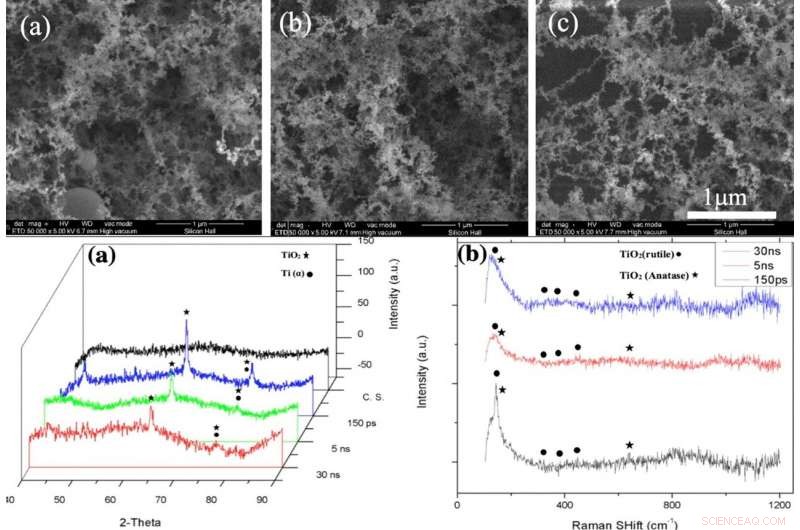
IN ALTO:immagini SEM dello strato NFTi (Nanofibrous Titania) con potenza = 10 W, frequenza = 600 KHz (a) durata dell'impulso = 150 ps, (b) durata dell'impulso = 5 ns, (c) durata dell'impulso = 30 ns con ingrandimento 50000X. IN BASSO:(a) modello XRD, (b) Spettro Raman di vetro nudo e campioni rivestiti da titania con diverse durate di impulso (creato da Origin Pro 2019B (GF3S4-3089-7907079) https://www.originlab.com/). Credito:rapporti scientifici, doi:10.1038/s41598-019-54533-z.
I team di ricerca avevano precedentemente utilizzato diverse tecniche per produrre superfici di materiali BTE tra cui sol-gel, idrotermale 106, elettrofilatura e stampa 3D; però, selezionare un metodo ideale rimane una sfida. Ad esempio, i biomateriali artificiali devono interagire senza sforzo con i fluidi fisiologici e assimilarsi con i tessuti circostanti duri e molli per mantenere l'attività cellulare per una biocompatibilità superiore. Scienziati dei materiali e bioingegneri avevano usato il titanio e le sue leghe per impianti ortopedici, consentendo l'osteogenesi basata su nanoparticelle di titanio (NP) delle cellule staminali della polpa dentale e delle cellule staminali derivate dal tessuto adiposo. I metodi di modifica della superficie del laser possono modificare le superfici dei materiali per una migliore biocompatibilità della superficie; dove il metodo HILIRT aveva precedentemente mostrato il potenziale per progettare componenti lab-on-a-chip e altri biomateriali biocompatibili. Gli scienziati possono alterare i parametri laser per manipolare le superfici dei materiali per favorire la differenziazione cellulare.
Nel presente lavoro, Beigi et al. ha studiato gli effetti della durata dell'impulso laser sulle superfici dei materiali utilizzando il metodo HILIRT e ha testato il comportamento biologico dei biomateriali sintetici utilizzando la caratterizzazione dei materiali e test biologici in laboratorio. Hanno studiato il contatto cellula-materiale sulle superfici dei materiali usando l'espressione genica, studi di mineralizzazione e interazione proteica. Gli scienziati hanno sviluppato un film sottile di titanio nanofibroso (NFTi) e lo hanno immerso in un fluido corporeo simulato (SBF) per formare strutture a strati simili a idrossiapatite (HA) e hanno identificato le modifiche superficiali del materiale utilizzando l'angolo di contatto con l'acqua (CA), microscopia elettronica a scansione (SEM), analisi della spettroscopia a raggi X a dispersione di energia (EDS), spettroscopie micro-Raman e diffrazione di raggi X (XRD).
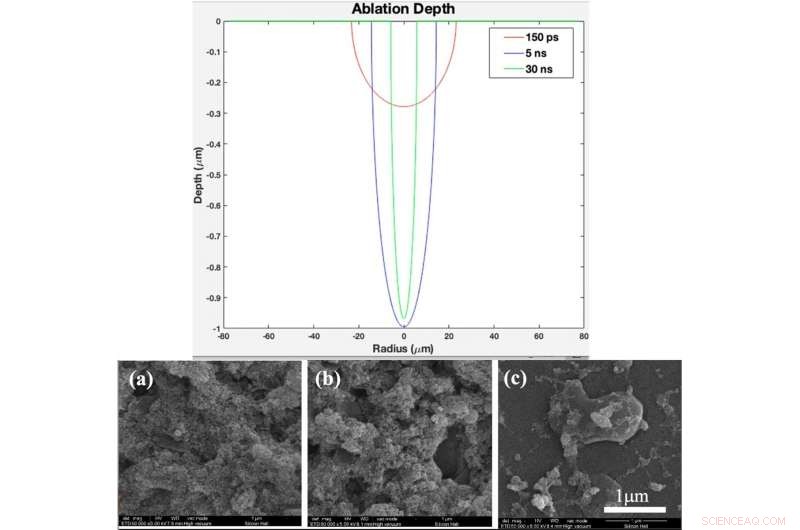
IN ALTO:Profilo teorico della profondità di ablazione in funzione del raggio per la durata dell'impulso di 150 ps, 5 ns, e 30 ns (creato nel software MATLAB R2015b (9.6.0.1072779) https://www.mathworks.com). IN BASSO:(a) modello XRD, (b) spettro Raman di vetro nudo e campioni rivestiti da titania con diverse durate di impulso dopo 2 giorni di immersione in SBF, (c) XRD pattern, (d) Raman spectrum of bare glass and samples coated by titania with different pulse duration after 4 days immersion in SBF Fig. 4. (a). XRD pattern, (b) Raman spectrum of bare glass and samples coated by titania with different pulse durations (created by Origin Pro 2019B (GF3S4-3089-7907079) https://www.originlab.com/). Credito:rapporti scientifici, doi:10.1038/s41598-019-54533-z.
They deposited NFTi (nanofibrous titania) structures at different pulse durations to form laser nanofiber coated smooth surfaces and tested the chemical and physical composition of the resulting advanced materials. When they decreased pulse duration, the titanium weight percentage increased, and the scientists observed the temperature of the irradiated zone to be significantly higher for a shorter pulse duration of 150 picoseconds (ps) compared with 5 nanoseconds (ns) and 30 ns. The decreased pulse duration transmitted power to the target in a shorter time, causing the heat affected zone (HAZ) to have a higher temperature, allowing a denser plasma plume to form more NFTi structures on a glass substrate. Decreasing the laser pulse duration created more biocompatible Ti nanofibers with a higher content of HA(hydroxyapatite)-like substance sedimentation on the samples.
Using phase-contrast microscopy images of fibroblast-like BMSCs on titania-coated glass surfaces, Beigi et al. observed normal cell morphology. They measured water contact angles of droplets of water on the material specimens and conducted cytotoxicity tests with MTS assays on stem cells grown on NFTi coatings. The materials coated with NFTi for 150 ps showed the highest absorbance rate (known as the S1 group) with subsequently high rates of cell viability, cell adhesion and metabolic activity. When the researchers used immunofluorescent staining to observe cell migration, the S1 sample (with NFTi coating for 150 ps) showed higher rates of cell migration. To confirm stem cell (BMSC) differentiation, the scientists investigated osteogenic-related gene expression with RUNX2, collagen I, osteopontin and osteonectin genes, using quantitative qRT-PCR. Tra i campioni, S1 samples indicated significantly higher relative expression for all osteogenic-related genes.
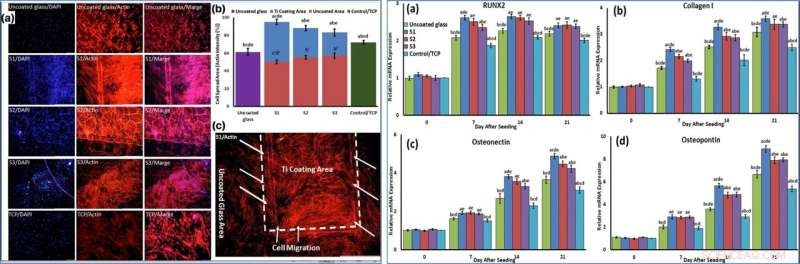
LEFT:Cells were stained by phalloidin to observe (a, c) and quantify (b) actin filament expansion and migration in all samples after 7 days. The first column in A is DAPI nuclear staining (blue), second column, phalloidin labelled F-actin (red), and third column, overlaid fluorescent image of immunostained cellular components (merge:DAPI/F-actin). The red bars in B indicate the intensity percentage of actin filament on the glass in S1, S2, and S3 samples and the blue bars describe the intensity percentage of actin filament the NFTi coated area. (c) Higher magnification of BMSCs migration from glass area toward Ti coating area in S1. RIGHT:The mRNA relative expression levels of osteogenic genes included Runx2 (a), Collagen I (b), Osteonectin (c), and Osteopontin (d) determined by qRT-PCR for all samples. Credito:rapporti scientifici, doi:10.1038/s41598-019-54533-z.
To confirm mineralization, the scientists used alizarin red followed by soluble Ca nodules color absorbance quantification, to observe high levels of mineralization on all samples on days seven and 14. The team investigated surface protein absorption potential, protein-ion biocomplex formation and biocomplex cell uptake to demonstrate highest levels of protein-ion biocomplex formation on the S1 samples.
In questo modo, Mohammad-Hossein Beigi and colleagues used the HILIRT method to achieve high surface bioreactivity, osteogenesis and osseointregration of NFTi-BMSCs. The surface character of the new materials allowed protein and biomolecule interactions to stimulate cell adhesion, mineralization and osteogenesis for faster and more suited osseointegration in vivo and in vitro. The scientists engineered nanofiber mesh-like scaffolds using titanate to allow vascularization, protein attachment, cell proliferation and cell attachment on the substrate. Such microporous surfaces can promote nutrition diffusion, vascularization and blood flow due to improved biomechanical strength. Inoltre, the hydrophilic surface property; verified using water contact angle measurements, facilitated cell-ECM adhesion to improve cell binding and vigorous tissue growth.
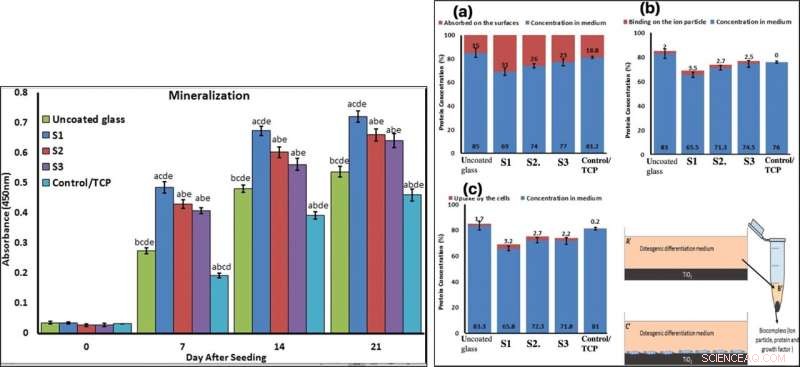
LEFT:Confirmation of osteogenic differentiation and matrix mineralization of BMSCs by quantifying alizarin red staining. RIGHT:Protein adsorption and biocomplex adsorption/absorption:concentration of protein in osteogenic differentiation medium after 6 hours of immersion (a); concentration of protein in osteogenic differentiation medium after 6 hours of immersion and then centrifuged at 14, 000 rpm for 30 min (b); concentration of protein in osteogenic differentiation medium after 6 hours of immersion with cell culture (c). Credito:rapporti scientifici, doi:10.1038/s41598-019-54533-z.
The S1 sample (NFTi, 150 ps) developed in this work generated the best surface bioreactivity for bone regeneration or bone replacement. Beigi et al. showed the advantages of using titania as an orthopedic implant material and the surface modification strategies implemented in the study improved surface bioreactivity and osteogenesis for assisted bone tissue development. The cost-effective frugal method can provide a metallic nanofiber structure surface to be coated on multiple surfaces for varied biomedical applications. The proposed technique (combining materials engineering with stem cells) will open new doors to engineer advanced biomaterials with enhanced surface bioreactivity for improved biocompatibility in vitro and in vivo. The findings demonstrate beneficial effects of an experimental scaffold in the lab with potential for medical osseointegration as a BTE implant.
© 2019 Scienza X Rete