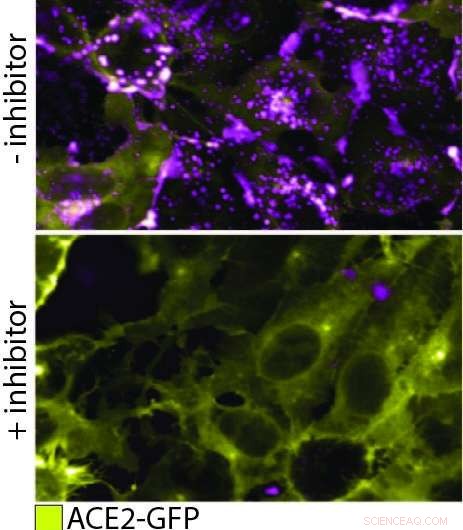
QD608-RBD lega ACE2 e induce l'endocitosi. In questa figura, il pannello superiore mostra le cellule che esprimono ACE2-GFP (giallo) che legano e internalizzano QD608-RBD (magenta). Nel pannello inferiore, viene aggiunto un inibitore per prevenire il legame di QD608-RBD a ACE2-GFP, e la presenza di ACE2-GFP sulla superficie cellulare è forte con poco o nessun QD608-RBD visibile. Attestazione:NCTS
"Quello che stiamo facendo qui è in realtà visualizzare il legame del picco all'ACE 2 [enzima di conversione dell'angiotensina 2], " dice Kirill Gorshkov, ricercatore presso il National Center for Advancing Translational Sciences (NCATS) nel Maryland, NOI.
Per quanto innocuo possa sembrare a chi non lo sapesse, questo legame è il primo passo di un processo di proliferazione virale che potrebbe aver portato alla peggiore pandemia a memoria d'uomo. Il "picco" è una proteina del virus SARS-CoV-2 ampiamente riconosciuta come l'arma primaria di attacco per mobilitare il suo DNA virale in una cellula ospite. I recettori ACE2 sono proteine cellulari umane che aprono efficacemente la porta a questo attacco. Utilizzando punti quantici bioingegnerizzati, Gorshkov ed Eunkeu Oh al Naval Research Laboratory (NRL) di Washington, DC, ei loro colleghi sono stati in grado di immaginare il legame e la successiva interiorizzazione che avviene quando ACE2 e la proteina spike interagiscono. "Puoi effettivamente vederlo accadere in tempo reale, "aggiunge Gorshkov, "Questa è la bellezza di questo test ed è per questo che pensiamo che sarà importante per lo screening dei farmaci".
Un virus non può riprodursi senza arruolare una cellula ospite, così i ricercatori di tutto il mondo hanno lavorato per capire come SARS-CoV-2 interagisce e penetra nelle cellule con l'obiettivo di bloccare questa fase e prevenire l'insorgenza di COVID19. Gorshkov e i suoi colleghi della NCATS stavano già lavorando a vari test di imaging per i tumori, virus e malattie da accumulo lisosomiale, "ma quando il coronavirus ha colpito, abbiamo dovuto cambiare rapidamente marcia, "dice Gorshkov.
Una precedente ricerca sulla SARS aveva evidenziato l'importanza delle interazioni con ACE2 nelle cellule umane per la diffusione di questo tipo di virus, ed erano già in grado di etichettare queste proteine recettrici con una proteina fluorescente verde per visualizzare i loro movimenti. Si stavano anche accumulando prove per individuare le specifiche proteine spike su SARS-CoV-2 che potrebbero bloccare ACE2 in una roccaforte in modo che il virus possa entrare nella cellula. Però, le informazioni sulle interazioni delle proteine spike sono state per lo più accumulate indirettamente da saggi biochimici o di prossimità e da test con proteine e parti di proteine prelevate dal virus - "pseudo-viro-particelle". Senza etichettatura fluorescente di queste proteine virali, il loro ruolo nel legame del recettore ACE2 e nella successiva interiorizzazione - endocitosi - ha continuato a svolgersi efficacemente sotto il favore dell'oscurità per l'imaging.
A NRL, i ricercatori erano anche desiderosi di sfruttare la loro esperienza con le nanoparticelle per la consegna cellulare e il biosensore per aiutare gli sforzi nella ricerca di farmaci anti-COVID19. Oh ha iniziato a esaminare i possibili modi di applicare le tecniche di coniugazione proteina-nanostruttura con cui aveva lavorato per oltre 15 anni. Con due proteine che condividono un'affinità di legame, un punto quantico attaccato a una e una nanoparticella fluorescente attaccata all'altra, il legame tra le due proteine porterà le nanostrutture abbastanza vicine per il trasferimento di energia tra di loro.
L'estinzione della fluorescenza risultante consente quindi ai ricercatori di monitorare il legame proteico. "Se hai qualche inibitore nel mezzo per fermare il legame, questo può essere usato come test di inibizione per lo screening dei farmaci, quindi lo usiamo molto, " spiega Oh. Vedendo la potenziale applicazione per lo screening degli anticorpi contro il COVID19, Oh e il suo team guidato da Mason Wolak hanno presentato le loro idee al team di NCATS, e le due istituzioni si misero subito al lavoro per svilupparlo ulteriormente.
Sviluppo di uno "pseudovirion"
Il primo passo dalla parte di Oh della collaborazione è stato quello di sviluppare uno "pseudovirion" con le parti potenti delle proteine spike SARS-CoV-2 (dove si trova il dominio di legame del recettore) attaccate al punto quantico in modo tale che le proteine spike continuano ad attaccare e penetrare le cellule proprio come un virus attivo. Per questo, l'orientamento delle proteine spike e la forma dello pseudovirione erano fondamentali, e qui, La vasta esperienza di Oh nel coniugare proteine attive a nanostrutture ha dato i suoi frutti. Prima di passare ai più costosi test di consegna cellulare, hanno dovuto verificare se il loro pseudovirion funzionava al di fuori delle cellule coniugando nanoparticelle d'oro fluorescenti ai recettori ACE2 e monitorando l'estinzione della fluorescenza. Oh elenca i molteplici rapporti tra proteine e punti quantici, le dimensioni dei punti quantici e le sostanze chimiche di superficie che hanno provato prima di essere finalmente in grado di osservare l'estinzione della fluorescenza sul legame proteico, ed erano pronti a inviare lo pseudovirione alla squadra di Gorshkov "per fare cose interessanti con la cellula reale".
Per osservare lo pseudovirione che interagisce con ACE2 in una cellula reale, il punto quantico sullo pseudovirione ora doveva essere progettato per emettere a una lunghezza d'onda facile da distinguere dalla proteina fluorescente verde su ACE2, in contrasto con l'ottimizzazione dell'estinzione delle nanoparticelle. Con i due chiari segnali, il team di NCATS ha potuto monitorare il legame delle due proteine e la successiva endocitosi. Inoltre, potevano vedere che il legame e l'endocitosi erano prevenuti in presenza di due anticorpi di prova. Potrebbero anche testare il meccanismo di endocitosi, che procede per mezzo di una proteina denominata dynamin. Quando hanno aggiunto Dyngo-4a, che interrompe la dinamica, potevano vedere il legame avvenire ma nessuna successiva endocitosi.
I risultati indicano anche un successo per le collaborazioni di ricerca a distanza, poiché le squadre non si sono mai incontrate. "Il tipo di collaborazione che abbiamo qui è raro, "dice Gorshkov, riflettendo quanto i loro progressi abbiano superato le precedenti collaborazioni dove c'era stato un maggior numero di incontri fisici e attività coordinate. "C'era una tale spinta e una tale attenzione da parte di entrambi i gruppi che si è davvero sinergizzato molto bene".
Lo pseudovirione del punto quantico è limitato alla penetrazione delle cellule di imaging per endocitosi, e resta da determinare se questo meccanismo entrerà in vigore per tutti i tipi di cellule, tessuto polmonare in particolare. Un meccanismo di attacco SARS-CoV-2 alternativo si basa sulla fusione della membrana, e l'imaging di questo con lo pseudovirione del punto quantico richiederebbe modifiche significative per interagire con la cellula più come una membrana. Però, la velocità di trasmissione e le osservazioni dirette consentite dallo pseudovirione a punti quantici dovrebbero rappresentare vantaggi significativi nella ricerca di anticorpi.
© 2020 Scienza X Rete