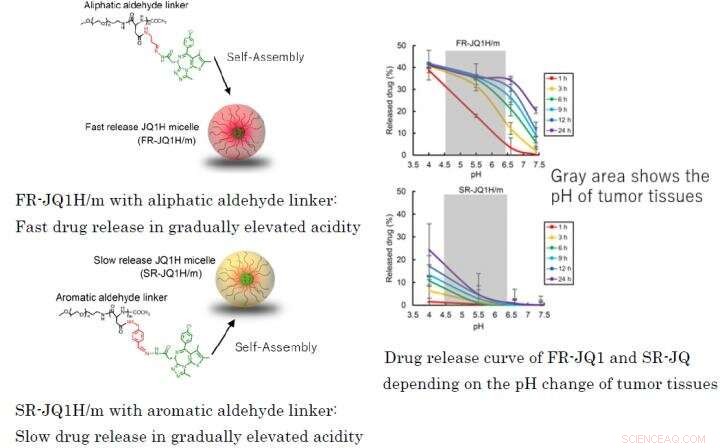
Fig. 1:Diverso profilo di rilascio del farmaco a seconda del linker utilizzato per i copolimeri a blocchi di nano-micelleFR-JQ1H/m con linker aldeidico alifatico:rilascio rapido del farmaco in acidità gradualmente elevataSR-JQ1H/m con linker aldeidico aromatico:rilascio lento del farmaco in acidità gradualmente elevata Curva di rilascio del farmaco di FR-JQ1 e SR-JQ a seconda della variazione del pH dei tessuti tumorali Credito:2021 Innovation. Centro di NanoMedicina
Il Centro Innovazione di NanoMedicina riportato in ACS Nano insieme al gruppo del Prof. Yu Matsumoto di Otorinolaringoiatria e Chirurgia Cervico Facciale e al gruppo del Prof. Horacio Cabral del Dipartimento di Bioingegneria dell'Università di Tokyo che l'efficacia delle nano-micelle polimeriche con diverso profilo di attivazione del farmaco dipende dalla livello di espressione di c-Myc, uno dei principali proto-oncogeni, è stato sviluppato.
È noto che c-Myc è coinvolto nella proliferazione e nell'angiogenesi delle cellule tumorali e modifica il ciclo cellulare, sopprime la normale differenziazione cellulare, e promuove le metastasi del cancro. È un tipico proto-oncogene che regola molti geni legati ai fattori di crescita ed è noto per essere coinvolto nello sviluppo di molti tumori, come la traslocazione cromosomica nel linfoma di Burkitt. Perciò, La ricerca sulla scoperta di nuovi farmaci viene condotta in tutto il mondo come farmaco antitumorale mirato a questo fattore di trascrizione che può attaccare direttamente le cellule staminali del cancro. Però, poiché la mortalità embrionale si verifica nei topi knockout c-Myc, c-Myc è considerato un gene essenziale per le cellule viventi, e la consegna selettiva ai tessuti del cancro è una chiave importante per lo sviluppo dei suoi inibitori. Oltretutto, c-Myc è anche noto come fattore necessario per l'induzione iniziale delle cellule iPS. In futuro ci si può aspettare che questa inibizione venga applicata come tecnologia che può essere utilizzata anche per sopprimere la carcinogenesi derivata dalle cellule iPS.
In questo studio, JQ1H, che è un analogo strutturale di JQ1H, un tipico inibitore indiretto di c-Myc, è stato incapsulato all'interno di nano-micelle funzionali, e ne è stata valutata l'efficacia. JQ1 si lega a una proteina del bromodomino chiamata BRD4, che è coinvolto nell'attivazione della RNA polimerasi II che regola l'espressione di c-Myc, per inibire fortemente questo flusso. Di conseguenza, l'attività della RNA polimerasi è indebolita e l'espressione di c-Myc è down-regolata. Sebbene JQ1 fosse previsto come un promettente farmaco per l'epigenoma a causa della sua forte inibizione dell'espressione genica, ha un'emivita estremamente breve in vivo a causa della sua rapida escrezione renale e rapida eliminazione dopo la somministrazione. Inoltre, JQ1 è quasi insolubile in acqua. Queste proprietà di JQ1 sono diventate grandi problemi per svilupparlo come farmaco efficace. Le nano-micelle polimeriche sviluppate finora presso l'Innovation Center of NanoMedicine (iCONM), per la terapia antitumorale, dimostrato (1) stabilizzazione di farmaci incapsulati, (2) soppressione dell'escrezione renale, (3) Accumulo di tumore mediato da EPR (consegna selettiva di farmaci ai tessuti cancerosi), e (4) rilascio del farmaco basato sull'acidosi tumorale. Questa volta, abbiamo confermato una buona attività antitumorale in topi trapiantati con cancro alla lingua, melanoma e cancro del pancreas utilizzando nano-micelle dotate di JQ1.
superiore:cancro alla lingua, inferiore:cancro al pancreas. Credito:2021 Innovation Center di NanoMedicina
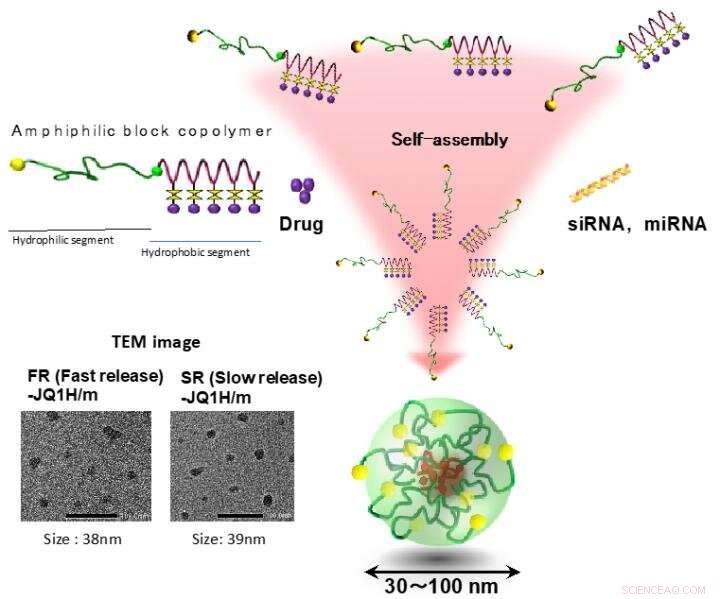
Le micelle polimeriche sono state uno dei primi autoassemblaggi polimerici riportati come nano-DDS, e sono composti da due distinti domini, un nucleo di caricamento del farmaco e un guscio idrofilo. copolimeri a blocchi anfifilici, contenente un blocco idrofilo e un blocco idrofobo, si rivelano in primo luogo per costruire quei domini distinti in una struttura micellare attraverso l'autoassemblaggio spontaneo a seguito di interazioni idrofobiche in acqua. H. Cabral, K. Miyata, K. Osada, K. Kataoka, "Micelle di copolimero a blocchi in applicazioni di nanomedicina" Chem. Rev. 2018, 118 6844-6892. (DOI:10.1021/acs.chemrev.8b00199). Credito:2021 Innovation Center di NanoMedicina
Le nano-micelle contenenti JQ1H penetrano nel tessuto tumorale dai vasi sanguigni dopo la somministrazione sistemica a causa del cosiddetto effetto EPR. I tessuti tumorali sono ricchi di acido lattico grazie alla sua glicolisi potenziata ed è più acido dei tessuti normali. In questo lavoro, sono stati preparati due tipi di nano-micelle; uno in cui JQ1H idrofobo era legato a un polimero a blocchi anfifilico composto da un blocco di glicole polietilenico idrofilo e un blocco di poliamminoacido idrofobo utilizzando il linker 3-aminopropionaldeide (aldeide alifatica) e l'altra micella in cui JQ1H era legato al polimero tramite p-amminometilbenzaldeide ( aldeide aromatica) linker. Un polimero a blocchi anfifilico è stato sintetizzato e utilizzato come materiale di base per nano-micelle. Quando è stato autoassemblato in acqua in una struttura micellare e somministrato a topi portatori di cancro, l'attività antitumorale è stata raggiunta.
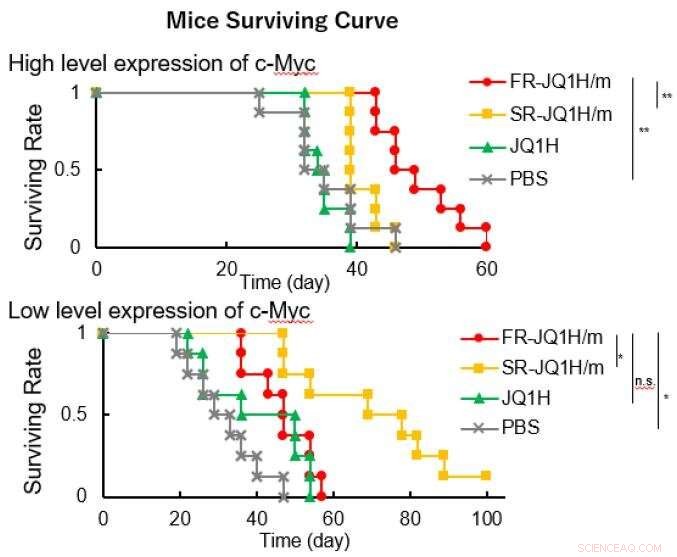
Quando il linker è un'aldeide alifatica o quando è un'aldeide aromatica, il modello di rilascio del farmaco differisce notevolmente dipende dall'acidità. Il primo rilascia il farmaco rapidamente, e quest'ultimo rilascia il farmaco lentamente. Perciò, la prima nanomedicina è stata denominata FR-JQ1H/m e la seconda è stata denominata SR-JQ1H/m. L'attività antitumorale di queste nano-micelle differisce notevolmente a seconda del livello di espressione di c-Myc. Mentre, FR-JQ1H/m è più efficace per i tumori con elevata espressione di c-Myc, SR-JQ1H/m è più efficace per i tumori con bassa espressione di c-Myc.
Nel futuro, riteniamo che la selezione di nano-micelle in base al livello di espressione dei biomarcatori sarà un passo importante verso la realizzazione di medicina personalizzata e ospedali interni.