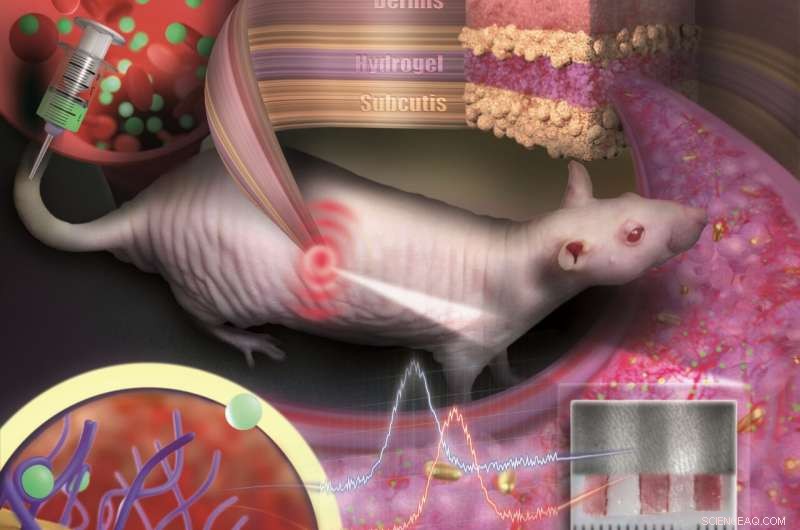
Le nanoparticelle d'oro incorporate in un idrogel poroso possono essere impiantate sotto la pelle e utilizzate come sensori medici. Il sensore è come un tatuaggio invisibile che rivela i cambiamenti di concentrazione delle sostanze nel sangue tramite il cambiamento di colore. Credito:gruppo di nanobiotecnologie, Dipartimento di Chimica JGU
L'idea di sensori impiantabili che trasmettano continuamente informazioni sui valori vitali e sulle concentrazioni di sostanze o farmaci nell'organismo affascina da tempo medici e scienziati. Tali sensori consentono il monitoraggio costante della progressione della malattia e del successo terapeutico. Però, fino ad ora, i sensori impiantabili non sono stati adatti a rimanere permanentemente nel corpo e richiedono la sostituzione dopo alcuni giorni o settimane.
C'è anche il problema del rigetto dell'impianto in quanto il sistema immunitario riconosce il sensore come un oggetto estraneo. Con molte tecnologie, il colore del sensore, che indica variazioni di concentrazione, è instabile e svanisce nel tempo. Gli scienziati della Johannes Gutenberg University Mainz (JGU) hanno sviluppato un nuovo tipo di sensore impiantabile che può essere impiantato nel corpo per diversi mesi. Il sensore si basa su nanoparticelle d'oro a colore stabile che vengono modificate con recettori per molecole specifiche. Incorporato in un tessuto polimerico artificiale, il nanogold viene impiantato sotto la pelle, dove riporta cambiamenti nelle concentrazioni del farmaco cambiando il suo colore.
Il gruppo di ricerca del professor Carsten Soennichsen presso la JGU ha utilizzato per molti anni le nanoparticelle d'oro come sensori per rilevare piccole quantità di proteine nelle cellule a flusso microscopiche. Le nanoparticelle d'oro fungono da piccole antenne per la luce:la assorbono e la disperdono fortemente, e appaiono colorati. Reagiscono alle alterazioni nell'ambiente circostante cambiando colore. Il team di Soennichsen ha sfruttato questo concetto per il rilevamento medico impiantato.
Per evitare che le minuscole particelle si disperdano o vengano degradate dalle cellule immunitarie, sono incorporati in un idrogel poroso con una consistenza simile a un tessuto. Una volta impiantato sotto la pelle, piccoli vasi sanguigni e cellule crescono nei pori. Il sensore è integrato nel tessuto e non viene rifiutato come corpo estraneo. "Il nostro sensore è come un tatuaggio invisibile, non molto più grande di un centesimo e più sottile di un millimetro, ", ha affermato il professor Carsten Soennichsen, capo del gruppo nanobiotecnologie presso JGU. Poiché le nanoparticelle d'oro si riflettono nella lunghezza d'onda dell'infrarosso, non sono visibili ad occhio nudo. Però, uno speciale tipo di dispositivo di misurazione può rilevare il loro colore in modo non invasivo attraverso la pelle.
Nel loro studio pubblicato in Nano lettere , i ricercatori della JGU hanno impiantato i loro sensori di nanoparticelle d'oro sotto la pelle di ratti glabri. I cambiamenti di colore in questi sensori sono stati monitorati in seguito alla somministrazione di varie dosi di un antibiotico. Le molecole del farmaco sono state trasportate al sensore attraverso il flusso sanguigno. Legandosi a specifici recettori sulla superficie delle nanoparticelle d'oro, inducono un cambiamento di colore che dipende dalla concentrazione del farmaco. Grazie alle nanoparticelle d'oro dal colore stabile e all'idrogel che integra i tessuti, il sensore è risultato rimanere stabile meccanicamente e otticamente per diversi mesi.
"Siamo abituati a oggetti colorati che si sbiancano nel tempo. Nanoparticelle d'oro, però, Non usare la candeggina, ma mantengono il loro colore in modo permanente. Poiché possono essere facilmente rivestiti con vari recettori, sono una piattaforma ideale per sensori impiantabili, " ha spiegato la dottoressa Katharina Kaefer, primo autore dello studio.
Il nuovo concetto è generalizzabile e ha il potenziale per estendere la durata dei sensori impiantabili. Nel futuro, sensori impiantabili basati su nanoparticelle d'oro potrebbero essere utilizzati per osservare contemporaneamente le concentrazioni di biomarcatori o farmaci nel corpo. Tali sensori potrebbero trovare applicazione nello sviluppo di farmaci, ricerca medica o medicina personalizzata, come la gestione delle malattie croniche.
Soennichsen ha avuto l'idea di utilizzare nanoparticelle d'oro come sensori impiantati nel 2004, quando ha iniziato la sua ricerca in chimica biofisica come professore junior a Magonza. Però, il progetto non è stato realizzato fino a 10 anni dopo in collaborazione con il Dr. Thies Schroeder e la Dr. Katharina Kaefer, entrambi scienziati della JGU. Schroeder aveva esperienza nella ricerca biologica e nella scienza degli animali da laboratorio e aveva già completato diversi anni di lavoro di ricerca negli Stati Uniti.
Kaefer era alla ricerca di un argomento interessante per il suo dottorato ed era particolarmente interessata alla natura complessa e interdisciplinare del progetto. I primi risultati hanno portato a uno stipendio assegnato a Kaefer dal Max Planck Graduate Center (MPGC) e al sostegno finanziario della Stiftung Rheinland-Pfalz für Innovation. "Un progetto del genere richiede molte persone con background scientifici diversi. Passo dopo passo, siamo riusciti a convincere sempre più persone della nostra idea, " disse Soennichsen. Alla fine, è stato un lavoro di squadra interdisciplinare che ha portato allo sviluppo di successo del primo sensore funzionale impiantato con nanoparticelle d'oro.