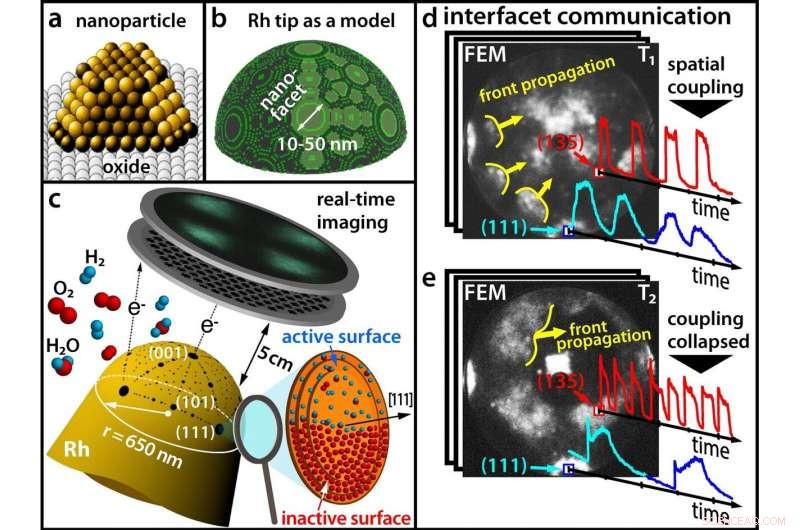
(a) I catalizzatori moderni sono costituiti da nanoparticelle; (b) Una punta di rodio come modello per una nanoparticella; (c) Tracciare una reazione chimica in tempo reale con un microscopio a emissione di campo (d) A basse temperature, diverse sfaccettature oscillano in sincronia (e) A temperature più elevate, la sincronicità è rotta. Credito:Università della Tecnologia di Vienna
La maggior parte dei prodotti chimici commerciali sono prodotti utilizzando catalizzatori. Generalmente, questi catalizzatori sono costituiti da minuscole nanoparticelle metalliche poste su un supporto ossidato. Simile a un diamante tagliato, la cui superficie è costituita da sfaccettature orientate in direzioni diverse, una nanoparticella catalitica possiede anche sfaccettature cristallograficamente diverse e queste sfaccettature possono avere proprietà chimiche diverse.
Fino ad ora, queste differenze sono rimaste spesso non considerate nella ricerca sulla catalisi perché è molto difficile ottenere contemporaneamente informazioni sulla reazione chimica stessa e sulla struttura superficiale del catalizzatore. A TU Wien (Vienna), questo è stato ora ottenuto combinando diversi metodi microscopici:con l'aiuto della microscopia elettronica di campo e della microscopia ionica di campo, è diventato possibile visualizzare l'ossidazione dell'idrogeno su una singola nanoparticella di rodio in tempo reale a una risoluzione nanometrica. Ciò ha rivelato effetti sorprendenti che dovranno essere presi in considerazione nella ricerca di catalizzatori migliori in futuro. I risultati sono stati ora presentati sulla rivista scientifica Scienza .
Il ritmo delle reazioni chimiche
"In alcune reazioni chimiche, un catalizzatore può passare periodicamente avanti e indietro tra uno stato attivo e uno inattivo, " afferma il prof. Günther Rupprechter dell'Institute of Materials Chemistry presso TU Wien. "Tra i due stati possono verificarsi oscillazioni chimiche autosufficienti:il chimico Gerhard Ertl ha ricevuto il premio Nobel per la chimica per questa scoperta nel 2007".
Questo è anche il caso delle nanoparticelle di rodio, che vengono utilizzati come catalizzatore per l'ossidazione dell'idrogeno, la base di ogni cella a combustibile. A determinate condizioni, le nanoparticelle possono oscillare tra uno stato in cui le molecole di ossigeno si dissociano sulla superficie della particella e uno stato in cui l'idrogeno è legato.
L'ossigeno incorporato modifica il comportamento della superficie
"Quando una particella di rodio è esposta a un'atmosfera di ossigeno e idrogeno, le molecole di ossigeno sono suddivise in singoli atomi sulla superficie del rodio. Questi atomi di ossigeno possono quindi migrare al di sotto dello strato superiore di rodio e accumularsi lì come ossigeno sotto la superficie, " spiega il prof. Yuri Suchorski, il primo autore dello studio.
Attraverso l'interazione con l'idrogeno, questi atomi di ossigeno immagazzinati possono quindi essere estratti di nuovo e reagire con gli atomi di idrogeno. Quindi, c'è di nuovo spazio per più atomi di ossigeno all'interno della particella di rodio e il ciclo ricomincia. "Questo meccanismo di feedback controlla la frequenza delle oscillazioni, "dice Yuri Suchorski.
Fino ad ora, si pensava che queste oscillazioni chimiche avvenissero sempre in modo sincrono nello stesso ritmo sull'intera nanoparticella. Dopotutto, i processi chimici sulle diverse sfaccettature della superficie delle nanoparticelle sono spazialmente accoppiati, poiché gli atomi di idrogeno possono migrare facilmente da una sfaccettatura alle sfaccettature adiacenti.
Però, i risultati del gruppo di ricerca del Prof. Günther Rupprechter e del Prof. Yuri Suchorski mostrano che le cose sono in realtà molto più complesse:in determinate condizioni, l'accoppiamento spaziale viene sollevato e le sfaccettature adiacenti oscillano improvvisamente con frequenze significativamente diverse e in alcune regioni della nanoparticella, queste "onde chimiche" oscillanti non si propagano affatto.
"Questo può essere spiegato su scala atomica, " dice Yuri Suchorski. "Sotto l'influenza dell'ossigeno, file sporgenti di atomi di rodio possono emergere da una superficie liscia." Queste file di atomi possono quindi agire come una sorta di "rompionde" e ostacolare la migrazione degli atomi di idrogeno da una sfaccettatura all'altra:le sfaccettature si disaccoppiano.
Se questo è il caso, le singole sfaccettature possono formare oscillazioni di frequenze diverse. "Su diverse sfaccettature, gli atomi di rodio sono disposti diversamente sulla superficie, " dice Günther Rupprechter. "Ecco perché anche l'incorporazione di ossigeno sotto le diverse sfaccettature della particella di rodio procede a velocità diverse, e così oscillazioni con frequenze diverse risultano su sfaccettature cristallograficamente diverse."
Una punta dell'emisfero come modello di nanoparticelle
The key to unraveling this complex chemical behavior lays in using a fine rhodium tip as a model for a catalytic nanoparticle. An electric field is applied, and due to the quantum mechanical tunneling effect, electrons can leave the tip. These electrons are accelerated in the electric field and hit a screen, where a projection image of the tip is then created with a resolution of around 2 nanometers.
In contrast to scanning microscopies, where the surface sites are scanned one after the other, such parallel imaging visualizes all surface atoms simultaneously—otherwise it would not be possible to monitor the synchronization and desynchronization of the oscillations.
The new insights into the interaction of individual facets of a nanoparticle can now lead to more effective catalysts and provide deep atomic insights into mechanisms of non-linear reaction kinetics, pattern formation and spatial coupling.