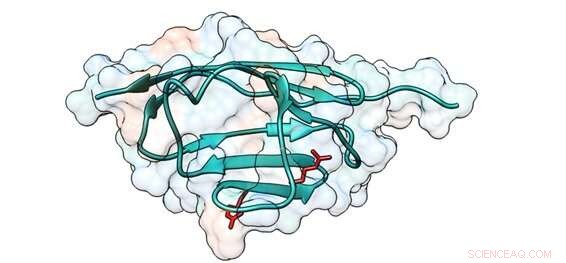
Schema di una regione cMyBP-C in cui le mutazioni causano cambiamenti di aminoacidi che alterano le proprietà meccaniche della proteina. Le posizioni degli amminoacidi interessati sono mostrate in rosso. Credito:CNIC
Gli scienziati del Centro Nacional de Investigaciones Cardiovasculares (CNIC) hanno descritto un potenziale meccanismo che causa la malattia nella cardiomiopatia ipertrofica (HCM), la più frequente malattia ereditaria del cuore. Lo studio, pubblicato sulla rivista ACS Nano , fornisce la prima descrizione di un'associazione tra questa malattia e alterazioni meccaniche di un componente del macchinario contrattile del cuore.
Il muscolo cardiaco è sottoposto a uno stress meccanico costante per tutta la vita poiché si contrae per pompare il sangue nel corpo. Il laboratorio guidato dal Dr. Jorge Alegre-Cebollada indaga come le proprietà meccaniche delle proteine cardiache determinano il comportamento fisiologico di questo muscolo e come le alterazioni di queste proprietà portano alla comparsa di malattie come l'HCM. In questa malattia, la malattia ereditaria più frequente che colpisce il cuore, il ventricolo sinistro si ingrandisce, e le manifestazioni gravi includono insufficienza cardiaca e morte improvvisa.
Gli scienziati sanno da più di 20 anni che l'HCM è causata da mutazioni nelle proteine con una funzione meccanica nel cuore. Una delle sfide della genetica cardiovascolare è identificare quale tra le varianti genetiche trovate nei pazienti e nelle loro famiglie causa la malattia. Sapere se una mutazione è causa di malattia o meno è importante perché queste informazioni determineranno il follow-up clinico dei membri della famiglia e, potenzialmente, loro trattamento.
Il nuovo studio, coordinato dal Dott. Jorge Alegre-Cebollada, ha analizzato la proteina C legante la miosina cardiaca (cMyBP-C).
La prima autrice Carmen Suay-Corredera ha spiegato che cMyBP-C, che regola la contrazione del cuore, è la proteina più frequentemente mutata nei pazienti con HCM. "Un'alta percentuale di mutazioni nel gene cMyBP-C causa cambiamenti di aminoacidi nella proteina; tuttavia, i meccanismi con cui queste mutazioni causano l'HCM non sono noti con precisione".
Il gruppo del Dr. Alegre-Cebollada, in stretta collaborazione con ricercatori clinici e molecolari in Europa e negli Stati Uniti, creare un database di varianti di cMyBP-C con un chiaro collegamento all'HCM al fine di definire i difetti molecolari alla base della malattia.
Utilizzando la bioinformatica e approcci sperimentali, il team di ricerca ha scoperto che circa la metà di queste mutazioni influenza l'integrità dell'RNA messaggero (mRNA) o della proteina cMyBP-C. Questi risultati sono già stati accettati per la pubblicazione nel Journal of Biological Chemistry e sono stati oggetto di un articolo di commento sulla principale rivista di genetica medica Genetica in Medicina .
Mentre le alterazioni dell'mRNA o dell'integrità proteica potrebbero spiegare la patogenicità di metà delle mutazioni analizzate nello studio precedente, Suay-Carredera ha sottolineato che l'altra metà non causa malattie attraverso questa via.
"Sono proprio queste varianti, che causano l'HCM attraverso meccanismi sconosciuti, che abbiamo analizzato nel nuovo studio, " ha spiegato il dottor Alegre-Cebollada, che guida il gruppo di Meccanica Molecolare del Sistema Cardiovascolare presso il CNIC.
Utilizzando tecniche biofisiche avanzate basate sulla microscopia a forza atomica, il team ha dimostrato che alcune delle mutazioni patogenetiche in cMyBP-C producono difetti nelle proprietà meccaniche della proteina che possono alterare la funzione contrattile dei cardiomiociti nei pazienti con HCM.
"Stiamo ora studiando i meccanismi che causano la malattia di quelle varianti che non sono state collegate ad alcuna alterazione rilevante in studi precedenti, " ha affermato il dott. Alegre-Cebollada. Per questo progetto, gli scienziati stanno lavorando con una serie di sistemi sperimentali, dai sistemi molecolari ai modelli animali di HCM.
L'identificazione dei meccanismi molecolari alla base dell'HCM è essenziale per determinare quali mutazioni di cMyBP-C causano la malattia. Questa conoscenza è quindi cruciale anche per il follow-up clinico e l'eventuale trattamento dei pazienti e delle loro famiglie, dicono gli autori.