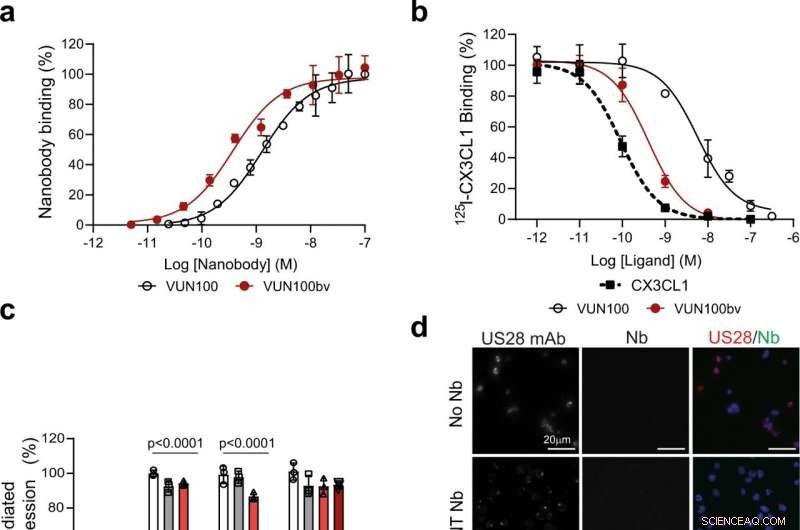
Fig. 1:VUN100bv si lega e inibisce la segnalazione US28. un Legame ELISA di VUN100 monovalente e VUN100bv bivalente a estratti di membrana di cellule HEK293T che esprimono US28. Figura rappresentativa di tre esperimenti indipendenti. B Spostamento di 125I-CX3CL1 dalle membrane che esprimono US28 da parte di un ligando non etichettato o dei nanocorpi VUN100 e VUN100bv. Figura rappresentativa di tre esperimenti indipendenti. C Effetto dei nanocorpi sull'attivazione di NFAT (fattore nucleare delle cellule T attivate) mediata da US28. Cellule HEK293T che esprimono solo reporter NFAT-luciferasi (Mock) o reporter NFAT-luciferasi insieme al recettore wildtype US28 (WT), mutante US28 Y16F (Y16F), mutante US28 ΔN (2–22) (ΔN (2–22)) o mutante US28 R129A (R129A). Le cellule non sono state trattate (untr) o trattate con un nanobody non mirato (NT Nb), VUN100, o VUN100bv per 24 h prima della misurazione della luminescenza. I dati sono stati normalizzati per i campioni WT non trattati. Figura rappresentativa di tre esperimenti indipendenti. D Microscopia di immunofluorescenza del legame di nanobody a cellule THP-1 che esprimono US28. US28 è stato rilevato utilizzando un anticorpo policlonale di coniglio anti-US28 (US28 mAb). Le cellule sono state incubate senza nanobody (No Nb), un NT Nb, VUN100, o VUN100bv. Il nanobody legato è stato rilevato utilizzando il Myc-tag presente sui nanobody e un anticorpo anti-Myc (Nb). Figura rappresentativa di tre esperimenti indipendenti. e Rilevazione Western blot per i livelli IFI16 totali di lisati di cellule trasdotte mock THP-1 non trattate (THP-1 Mock) o cellule THP-1 che esprimono US28 (THP-1 US28 WT). Le cellule THP-1 US28 WT non sono state trattate (Untr) o trattate con NT Nb, VUN100, o VUN100bv per 48 h. I livelli di proteina IFI16 sono stati determinati e normalizzati ai livelli di proteina actina. I livelli relativi della proteina IFI16 sono stati normalizzati ai lisati di cellule fittizie THP-1 non trattate. n = 3 esperimenti indipendenti da tre repliche biologiche indipendenti. Tutti i dati sono tracciati come media ± D.S. Per tutti i dati, ad eccezione della Fig. 1c, le analisi statistiche sono state eseguite utilizzando un test t a due code non appaiato. Per la Fig. 1c, la significatività statistica è stata determinata utilizzando il metodo Holm-Sidak (bilaterale con alfa = 0,05). I dati di origine vengono forniti come file di dati di origine. Credito:DOI:10.1038/s41467-021-24608-5
Gli scienziati hanno sviluppato un "nanocorpo", un piccolo frammento di un anticorpo di lama, in grado di scacciare il citomegalovirus umano (HCMV) mentre si nasconde dal sistema immunitario. Ciò consente quindi alle cellule immunitarie di cercare e distruggere questo virus potenzialmente mortale.
Si pensa che circa quattro persone su cinque nel Regno Unito siano infette da HCMV, e nei paesi in via di sviluppo questo può raggiungere il 95%. Per la maggior parte delle persone, il virus rimane dormiente, nascosto all'interno dei globuli bianchi, dove può rimanere indisturbato e inosservato per decenni. Se il virus si riattiva in un individuo sano, di solito non causa sintomi. Però, per le persone immunocompromesse, ad esempio, i trapiantati che hanno bisogno di assumere farmaci immunosoppressori per prevenire il rigetto d'organo:la riattivazione dell'HCMV può essere devastante.
Attualmente, non esiste un vaccino efficace contro l'HCMV, e i farmaci antivirali spesso si rivelano inefficaci o hanno effetti collaterali molto gravi.
Ora, in uno studio pubblicato su Comunicazioni sulla natura , i ricercatori della Vrije Universiteit Amsterdam nei Paesi Bassi e dell'Università di Cambridge hanno trovato un modo per cacciare il virus dal suo nascondiglio usando uno speciale tipo di anticorpo noto come nanobody.
I nanobodies sono stati identificati per la prima volta nei cammelli ed esistono in tutti i camelidi, una famiglia di animali che comprende anche dromedari, lama e alpaca. Gli anticorpi umani sono costituiti da due catene di molecole pesanti e due leggere, che insieme riconoscono e si legano a marcatori sulla superficie di una cellula o di un virus noti come antigeni. Per questa classe speciale di anticorpi camelidi, però, solo un singolo frammento dell'anticorpo, spesso indicato come anticorpo a dominio singolo o nanocorpo, è sufficiente per riconoscere correttamente gli antigeni.
Dr. Timo De Groof della Vrije Universiteit Amsterdam, il primo autore congiunto dello studio, disse:"Come suggerisce il nome, i nanocorpi sono molto più piccoli dei normali anticorpi, che li rendono perfettamente adatti a particolari tipi di antigeni e relativamente facili da produrre e regolare. Ecco perché vengono acclamati come aventi il potenziale per rivoluzionare le terapie anticorpali".
Il primo nanobody è stato approvato e immesso sul mercato dalla società biofarmaceutica Ablynx, mentre altri nanocorpi sono già in sperimentazione clinica per malattie come l'artrite reumatoide e alcuni tipi di cancro. Ora, il team nei Paesi Bassi e nel Regno Unito ha sviluppato nanocorpi che prendono di mira una specifica proteina virale (US28), uno dei pochi elementi rilevabili sulla superficie di una cellula infetta da HCMV latente e un driver principale di questo stato latente.
Il Dr. Ian Groves del Dipartimento di Medicina dell'Università di Cambridge ha dichiarato:"Il nostro team ha dimostrato che i nanocorpi derivati dai lama hanno il potenziale per superare in astuzia il citomegalovirus umano. Questo potrebbe essere molto importante in quanto il virus può causare complicazioni potenzialmente letali nelle persone il cui il sistema immunitario non funziona correttamente".
Negli esperimenti di laboratorio che utilizzano sangue infetto dal virus, il team ha dimostrato che il nanobody si lega alla proteina US28 e interrompe i segnali stabiliti attraverso la proteina che aiutano a mantenere il virus nel suo stato dormiente. Una volta rotto questo controllo, le cellule immunitarie locali sono in grado di "vedere" che la cellula è infetta, consentendo alle cellule immunitarie dell'ospite di cacciare e uccidere il virus, purgando il serbatoio latente e liberando il sangue dal virus.
Dott.ssa Elizabeth Elder, primo autore congiunto, che ha svolto il suo lavoro mentre era all'Università di Cambridge, ha dichiarato:"La bellezza di questo approccio è che riattiva il virus quanto basta per renderlo visibile al sistema immunitario, ma non abbastanza per fare ciò che fa normalmente un virus:replicarsi e diffondersi. Il virus è costretto a mettere la testa sopra il parapetto dove può poi essere ucciso dal sistema immunitario".
Professoressa Martine Smit, anche dalla Vrije Universiteit Amsterdam, ha aggiunto:"Riteniamo che il nostro approccio potrebbe portare a un nuovo tipo di trattamento tanto necessario per ridurre, e potenzialmente anche prevenire, l'infezione da CMV nei pazienti idonei per i trapianti di organi e cellule staminali".