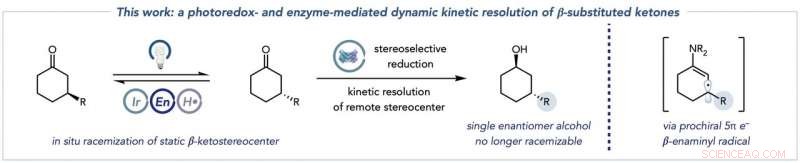
La trasformazione complessiva che combina la racemizzazione dei substrati chetonici (a sinistra) con la riduzione biocatalitica a prodotti alcolici enantiomericamente puri (al centro), e le specie chiave di radicali enaminilici che questa chimica sblocca per consentire la racemizzazione di -chetostereocentri tipicamente statici (a destra). Credito:Jacob DeHovitz
Una collaborazione tra due laboratori del Dipartimento di Chimica dell'Università di Princeton ha prodotto una nuova piattaforma sorprendente che consente ai chimici di reinterpretare le regole della stereochimica e dello stereocontrollo con importanti implicazioni per le industrie farmaceutiche e agrochimiche.
La ricerca dimostra la capacità della catalisi fotoredox di prendere stereocentri tradizionalmente statici e renderli dinamici rompendo e riformando i legami molecolari in modo continuo e controllabile. Mostra la promessa per gli scienziati di impostare gli stereocentri di un composto bersaglio complesso in modo succinto, passo efficiente piuttosto che uno stereocentro alla volta. (Uno stereocentro dà a una molecola un'asimmetria speculare, che è importante nel determinare le proprietà biologicamente attive durante la sintesi.)
La collaborazione unisce le competenze del laboratorio MacMillan e del laboratorio Hyster. La carta, "Stereocontrollo da statico a inducibilmente dinamico:l'uso convergente di chetoni -sostituiti racemici, " appare in Scienza questa settimana.
"Normalmente, quando pensi di costruire molecole con stereocentri al loro interno, pensi di fissare lo stereocentro nell'evento di formazione del legame, "ha detto Todd Hyster, assistente professore di chimica. "E quello che abbiamo scoperto è che se usi la catalisi fotoredox, puoi essenzialmente sbloccare meccanismi per creare stereocentri che altrimenti sarebbero statici, o fisso. Puoi renderli dinamici.
"Quando si accoppiano quelli con enzimi altamente selettivi, puoi pensare di costruire molecole stereochimicamente complesse in modi completamente nuovi."
La stereochimica coinvolge la disposizione spaziale degli atomi e come possono essere manipolati nella struttura molecolare per i risultati desiderati. Deriva dal fatto che il carbonio ha quattro sostituenti. Questi quattro sostituenti sono diversi; devono esistere come immagini speculari l'una dell'altra. Queste immagini speculari sono chiamate enantiomeri. Le nostre mani sono enantiomeri, Per esempio; sono immagini speculari l'una dell'altra. Ciò significa in pratica che non possono essere sovrapposti:un guanto per la mano sinistra non si adatta alla mano destra.
Il corpo umano risponde ai farmaci esattamente allo stesso modo. La nostra materia biologica è costituita da una serie di immagini speculari e non dall'altra. Il corpo può riconoscere la differenza tra due farmaci che sembrano identici anche se uno è un'immagine speculare e l'altro no. Tale riconoscimento influenza l'assorbimento e quindi l'efficacia delle terapie.
Quello che la ricerca MacMillan e Hyster ha scoperto è un modo per disaccoppiare la configurazione dello stereocentro dalla fase in cui si forma, o racemizzato. Essere in grado di controllare questa racemizzazione è importante per lo sviluppo dei farmaci più efficaci.
"Ci sono molti, molte ragioni per cui questa è una ricerca entusiasmante, non ultimo dei quali puoi praticamente creare una molecola e puoi dire, forse mi piacerebbe davvero cambiare quello stereocentro per farlo diventare qualcos'altro. Puoi davvero tornare indietro e farlo, "ha detto David MacMillan, il James S. McDonnell Distinguished University Professor di Chimica. "Questo è qualcosa che non pensiamo sia mai stato fatto in questo modo prima nella chimica organica e quindi apre alcune notevoli opportunità".
Gli enzimi migliorano i risultati
È stata l'introduzione di enzimi altamente selettivi nel processo che ha guidato i progressi dell'indagine dalla ricerca "B+ ad A+", ha detto MacMillan.
"Gli enzimi hanno questo modo di essere in grado di impartire quello che viene chiamato stereocontrollo, o introducendo forme molto specifiche per fare la chimica che i catalizzatori ordinari non possono fare, " ha detto. "Riunendo queste due idee, consente un approccio completamente nuovo al modo in cui si costruisce la stereochimica."
C'è molto da fare sotto il cofano in questo processo. Quando gli scienziati sintetizzano un composto con diversi stereocentri, presuppongono che il centro non possa capovolgersi o diventare dinamico una volta "impostato". Le molecole vengono sintetizzate in sequenza:si forma un centro, e poi è bloccato; e poi un altro si forma, e poi è bloccato, e così via.
Jacob De Hovitz, uno studente laureato del quinto anno nel laboratorio Hyster e autore principale dell'articolo, ha spiegato come la reazione descritta in questa ricerca consente agli scienziati di sbloccare quell'impostazione.
Ci sono due parti importanti della reazione. Nella prima metà, due specie chiave sono formate da un materiale di partenza chetonico. La prima specie è chiamata enammina, chiave perché può essere preso di mira dal catalizzatore fotoredox. Una seconda specie, un radicale enaminilico, risulta da quel passaggio, e distrugge lo stereocentro molecolare originale e imposta il passo successivo nel processo.
"La seconda metà è la reazione biocatalitica. L'enzima in soluzione, in questo caso, principalmente chetoreduttasi:riduce uno di quegli enantiomeri chetonici, che ancora sono costantemente racemizzanti in soluzione, per formare un prodotto alcolico che non può subire racemizzazione nelle nostre condizioni. criticamente, l'altro enantiomero chetonico non reagisce con la chetoreduttasi perché non può entrare nel sito attivo dell'enzima. Questo bias per un enantiomero è importante perché impedisce alla chetoreduttasi di formare indesiderabili altri stereoisomeri alcolici.
"Se la reazione biocatalitica è combinata con le nuove condizioni di racemizzazione in cui gli enantiomeri del materiale di partenza sono costantemente racemizzati, quindi un chimico può teoricamente permettersi fino al 100% del prodotto desiderato, raddoppiando l'efficienza, " ha detto De Hovitz.
Questa ricerca rappresenta tre anni di indagine collaborativa da parte dei due laboratori.