Illustrazioni schematiche di bio-NG ad accoppiamento elettromeccanico che modulano l'attività delle cellule ispirate all'ECM. (A) Le fibre di collagene nell'ECM che convertono la forza intrinseca della cellula in bioelettricità, che costituisce anche l'architettura 3D di ECM. Questi segnali bioelettrici sono trasmessi da molecole segnale riempite tra fibre di collagene, così, per regolare l'attività cellulare e realizzare l'espressione funzionale delle cellule. (B) Diagramma schematico delle fibre piezoelettriche bioispirate nei bio-NG. L'interazione delle cellule con i bio-NG che emulano questo segnale bioelettrico nell'ECM induce, in risposta alle forze intrinseche prodotte dalle cellule, un campo elettrico locale che stimola e modula la loro attività cellulare. Credito:progressi scientifici, 10.1126/sciadv.abh2350 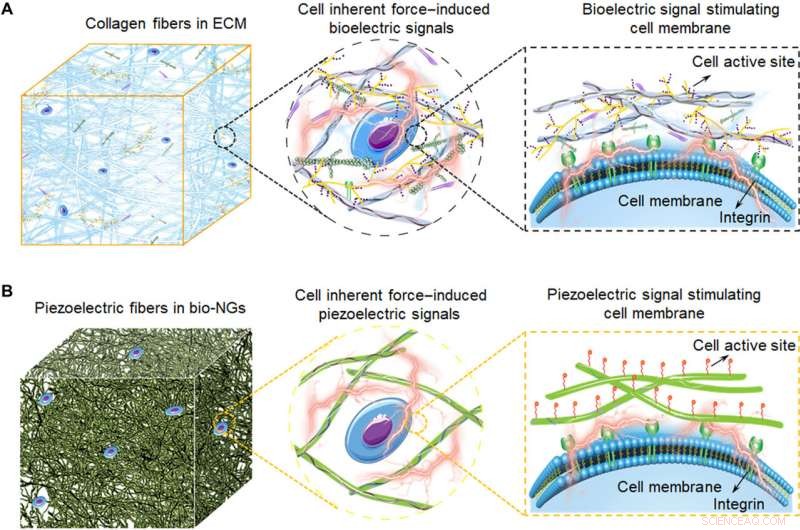
Lo spazio 3D unico all'interno dei bio-NG ha fornito un ambiente simile all'ECM per promuovere la crescita cellulare. I bio-NG hanno efficacemente promosso la vitalità e lo sviluppo cellulare per mantenere la sua specifica espressione funzionale. I ricercatori si aspettano che i nuovi e avanzati bio-NG mimino la complessità della matrice extracellulare e forniscano un sistema biologico in vivo fisiologicamente rilevante. Il dispositivo ha efficacemente promosso la vitalità e lo sviluppo cellulare per mantenere la sua specifica espressione funzionale. Li et al. si aspettano che la nuova e avanzata versione di bio-nanogeneratori fornisca un sistema biologico in vivo fisiologicamente rilevante per sostituire sistemi 2D e modelli animali imprecisi.
Guida per le cellule
In questo lavoro, Li et al. ha delineato una strategia pratica per la stimolazione elettrica wireless di cellule e tessuti per riparare e sostenere la funzione cellulare. La bioelettricità è un segnale biofisico che fornisce una guida per la crescita e la differenziazione cellulare durante lo sviluppo embrionale e la rigenerazione dei tessuti. La bioelettricità endogena esiste nel citoplasma e nello spazio extracellulare, fornendo agli scienziati una risorsa per la stimolazione elettrica delle cellule eccitabili e la regolazione dell'attività cellulare per applicazioni biomediche. La maggior parte dei metodi di trattamento richiede un input di energia esterna e una connessione cablata per applicare impulsi elettrici esterni attraverso microdispositivi impiantati. I recenti sviluppi della nanotecnologia hanno consentito trattamenti senza elettrodi e senza batterie, che includono l'uso di nanogeneratori per la stimolazione cerebrale, rigenerazione dei capelli e guarigione delle ferite. Però, la maggior parte di essi richiede una soluzione ben accettata per stimolare elettricamente le cellule funzionali. Li et al. sono stati quindi ispirati dalla funzione biologica e dalla microstruttura delle fibre di collagene nella matrice extracellulare per formare bio-NG composti da fibre elettrofilate piezoelettriche altamente discrete per fornire alle cellule un microambiente fisicamente rilevante. L'interazione bio-NG-cellula si applica agli ambienti in vivo per ridurre l'infiammazione, indurre la proliferazione degli epatociti, e accelerare l'angiogenesi, oltre a promuovere la riparazione del fegato.
Rappresentazione schematica e analisi piezoelettrica di bio-NG. (A) Schema schematico della fabbricazione di fibre Fe3O4/PAN piezoelettriche altamente discrete. Con l'aiuto del magnete al neodimio ferro boro, Le nanoparticelle magnetiche Fe3O4 sono state introdotte nella soluzione elettrofilata PAN per rompere la tensione superficiale dell'acqua. (B) Lo strato conduttivo PEDOT è stato caricato con il metodo della polimerizzazione in situ; I nanosheet di GO sono stati adsorbiti sullo strato più esterno di fibre grazie al contributo della forza di adsorbimento elettrostatico per formare le fibre GO/PEDOT/Fe3O4/PAN target. Immagini al microscopio elettronico a trasmissione della singola fibra ottenute in ogni passaggio. (C a E) Immagine ottica e immagini di microscopia elettronica a scansione (SEM) dei bio-NG. Il riquadro di (D) mostra la distribuzione delle dimensioni dei pori e la porosità. Il riquadro di (E) mostra l'intervallo di distribuzione del diametro della fibra delle fibre GO/PEDOT/Fe3O4/PAN. (F) Simulazione dell'analisi agli elementi finiti di fibre piezoelettriche accoppiate con una cellula vivente che genera una tensione massima di 141 mV quando sollecitata da una forza tangenziale di 10 nN. (G) Potenziale piezoelettrico generato da una singola fibra in funzione della forza della cella tangenziale applicata. (H) Circuito resistore-condensatore semplificato creato dal NG, l'interfaccia NG-cell, e la membrana cellulare. (I) Microscopia a forza piezoelettrica (PFM) di fase e immagini di ampiezza PFM di una singola fibra in bio-NG. (J) Isteresi del potenziale elettrico di fase e loop di ampiezza a farfalla delle fibre nei bio-NG, ottenuto con una tensione continua variabile da -10 a 10 V. (K) Uscite di tensione dai bio-NG sotto la stessa forza di impatto di 1 N (blu) e sotto una vibrazione a 0,7 Hz (rosso). L'inserto rappresentava i metodi di impatto (a sinistra) e di vibrazione (a destra) utilizzati per caratterizzare le fibre nei bio-NG. F, forza. Credito fotografico:Chuanmei Shi, Università della Scienza e della Tecnologia di Nanchino. Credito:progressi scientifici, 10.1126/sciadv.abh2350 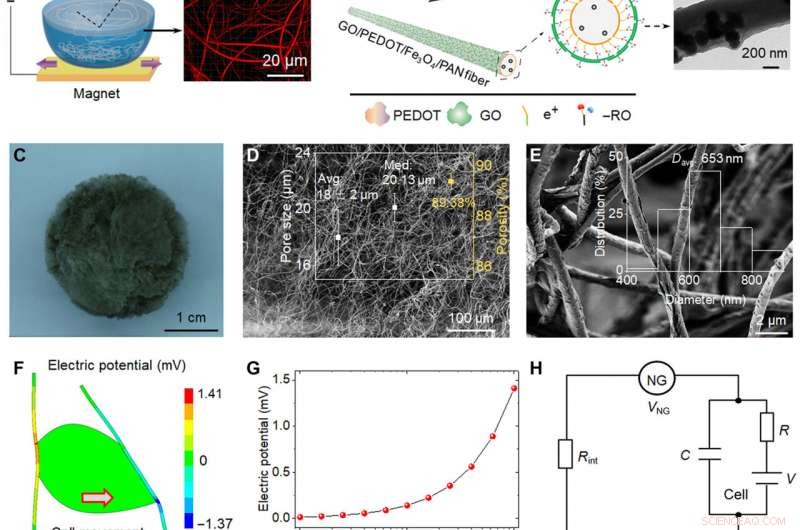
Durante gli esperimenti, il team di ricerca ha introdotto nanoparticelle magnetiche di ossido di ferro nel poliacrilonitrile per preparare fibre altamente discrete da utilizzare come dispositivo di elettrofilatura magneticamente assistita. Durante l'elettrofilatura, la configurazione ha consentito la formazione di scaffold con pori ben interconnessi e fibre discrete per la migrazione senza cellule. Per preparare un microambiente più vicino al vivo, il team ha anche impartito la bioelettricità come spunto biofisico. Per realizzare questo, gli scienziati hanno sviluppato un'impalcatura bersaglio per promuovere l'interazione cellulare e l'adesione con le fibre. L'accoppiamento elettromeccanico di bio-NG assemblati dallo scaffold ha promosso la trasmissione e la comunicazione di segnali tra le cellule per imitare gli effetti bioelettrici delle fibrille o fibre di collagene nella matrice extracellulare. Il team ha simulato e studiato il potenziale piezoelettrico generato dalla forza cellulare nei bio-NG utilizzando l'analisi degli elementi finiti. Per realizzare questo, hanno applicato una forza di carico al contatto cellula-fibra e prima hanno misurato la piezoelettricità di una singola fibra all'interno dei bio-NG utilizzando la microscopia a forza piezoelettrica. I segnali di tensione sperimentali hanno convalidato la piezoelettricità teorica dei bio-NG.
Caratterizzazione dei bio-NG e regolazione dell'attività cellulare
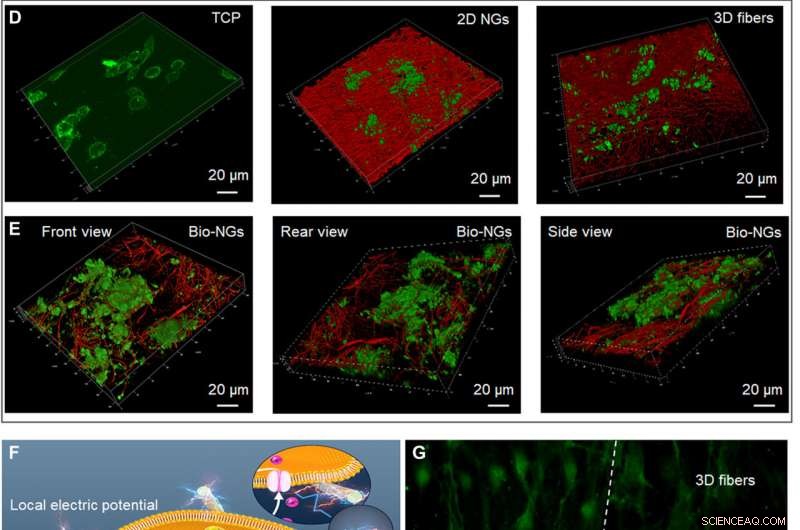
La crescita e lo sviluppo dei neuroni RGC5 nei bio-NG. (A) Proliferazione dei neuroni RGC5 mediante il test del DNA nei giorni 1, 3, e 5. (B) Apoptosi dei neuroni RGC5 dopo 5 giorni di coltura in bio-NG. (C) Escrescenza dei neuriti dei neuroni RGC5 dalla lunghezza mediana dei neuriti dopo 5 giorni di coltura in bio-NG. (D) Scansione confocale 3D di neuroni RGC5 coltivati su TCP, NG 2D, e fibre 3D. (E) Scansione confocale 3D di neuroni RGC5 coltivati in bio-NG da diverse prospettive. (F) Forza cellulare intrinseca delle cellule viventi cresciute in bio-NG. Ciò indurrebbe un campo elettrico locale proporzionale al livello di deformazione che potrebbe eventualmente alterare il potenziale di membrana e/o la configurazione dei recettori di membrana e provocare l'apertura dei canali del Ca2+. Ins3P, inositolo trifosfato. PLC, fosfolipasi C. (G) Le immagini di fluorescenza delle cellule preincubate con Fluo-4 AM (colorante permeabile alla membrana e Ca2+-dipendente) sulle fibre in bio-NG e fibre 3D. Verde, Ca2+. Tutte le barre di errore indicano ±SD. Credito:progressi scientifici, 10.1126/sciadv.abh2350
Per indagare le informazioni delle fibre nei bio-NG, il team ha utilizzato gli spettri dell'infrarosso a trasformata di Fourier (FTIR) e di diffrazione dei raggi X (XRD). Hanno quindi studiato le proprietà termodinamiche delle fibre piezoelettriche nei bio-NG utilizzando termogrammi di calorimetria a scansione differenziale (DSC) e hanno condotto studi di voltammogrammi ciclici per testare le proprietà di immagazzinamento di carica e trasmissione delle fibre piezoelettriche nei bio-NG. Il team ha quindi testato la resilienza alla compressione e le proprietà meccaniche delle fibre formandone prima delle forme cilindriche e comprimendo gli scaffold per comprendere l'eccellente resilienza dei costrutti. Le proprietà meccaniche e la resilienza delle fibre hanno assicurato che i bio-NG potessero mantenere efficacemente una dimensione dei pori abbastanza grande e un microambiente di crescita 3D stabile per il movimento e la crescita delle cellule. Il team ha anche studiato l'interazione NG-cellula nello spazio 3D con due diverse linee cellulari, tra cui
cellule gangliari retiniche 5 (RGC5) ed epatociti primari. Le cellule contenevano canali del calcio voltaggio-dipendenti nelle loro membrane e altre erano cellule mobili con elevate funzioni metaboliche. Utilizzando nanogeneratori bidimensionali (NG) e fibre 3D non piezoelettriche, il team ha studiato gli effetti dello spazio 3D e della stimolazione elettrica sulle cellule. I dati hanno mostrato come i bio-NG potrebbero fornire un microambiente di coltura cellulare biocompatibile per ulteriori esperimenti.
Promuovere la riparazione del fegato in vivo con i bio-NG
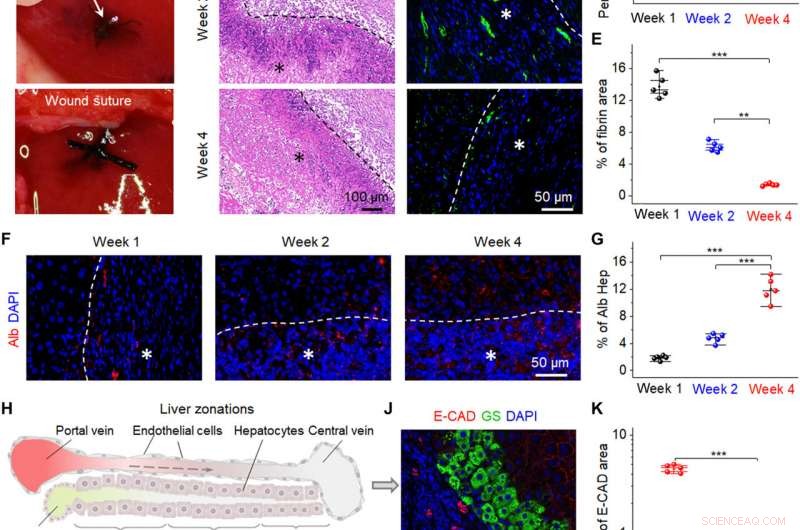
Promozione della riparazione del fegato da parte dei bio-NG in vivo. (A) Immagini chirurgiche che mostrano l'impianto dei bio-NG nel difetto epatico. (B) Colorazione H&E delle sezioni di fegato in diversi momenti (settimane 1, 2, e 4) dopo l'impianto. (C) Immagini rappresentative dell'immunocolorazione della fibrina epatica (ogeno) (verde) in 4 ', Sezioni di fegato controcolorate con 6-diamidino-2-fenilindolo (DAPI) (blu) nell'area dell'impianto. (D) Percentuale media dell'area positiva misurata dalla colorazione H&E. (E) Quantificazione dell'etichettatura immunofluorescente della fibrina epatica. (F) Immunocolorazione per Alb (rosso) su sezioni di fegato in diversi momenti (settimane 1, 2, e 4) dopo l'impianto. (G) Livello di espressione di Alb misurato dall'immunocolorazione di Alb. (H) Schema che mostra tre zone del fegato dalla regione periportale alla regione pericentrale. 1, 2, e 3 indicano la zona 1 (E-CAD+), zona 2 (E-CAD─GS─), e zona 3 (GS+), rispettivamente. La freccia tratteggiata indica il flusso sanguigno. (I e J) Immunocolorazione per GS (verde) ed E-CAD (rosso) su sezioni di fegato alla quarta settimana dopo l'impianto. (K) Quantificazione di GS ed E-CAD che mostra una maggiore espressione della funzione epatica di nuovi epatociti nei bio-NG rispetto a quella delle fibre 3D. Hep, epatocita. Gli asterischi (*) mostrano le posizioni dell'impianto. I dati sono espressi come valori medi ± DS. n =5. **P <0,01 e ***P <0,001. Credito fotografico:Fei Jin, Università della Scienza e della Tecnologia di Nanchino. Credito:progressi scientifici, 10.1126/sciadv.abh2350
Gli scienziati hanno quindi impiantato i bio-NG in un'area di danno epatico relativo alla rigenerazione degli epatociti per riflettere la loro praticità. Per realizzare questo, hanno usato ratti Sprague-Dawley per indurre danni al fegato. Dopo quattro settimane dall'impianto dei bio-NG, il team ha rimosso gli impianti e ha studiato l'infiammazione utilizzando la colorazione istologica. Hanno notato una lieve infiammazione nella prima settimana, che è migliorata entro la seconda settimana e ridotta a livelli normali entro la quarta settimana. Tutti gli altri organi non hanno mostrato deformazioni o invasione anormale delle cellule linfatiche per indicare buone condizioni di salute senza effetti collaterali sistematici. Il processo rigenerativo osservato ha evidenziato un nuovo sistema di circolazione sanguigna che si è formato all'interno del tessuto epatico rigenerato per suggerire l'interazione dei bio-NG con le cellule per ridurre l'infiammazione e promuovere la riparazione dei tessuti.
Stabilità a lungo termine e biocompatibilità dei bio-NG in vivo
L'interazione NG-cellula ha promosso in modo efficiente la vitalità cellulare e ha mantenuto la sua espressione funzionale in vitro e in vivo per fornire una strategia di trattamento per gli studi clinici. Per la rigenerazione dei tessuti, è più efficace trapiantare direttamente le cellule funzionali nel sito danneggiato in vivo. Per ulteriori studi, il team ha impiantato i bio-NG nell'area del muscolo gastrocnemio attorno al nervo sciatico dei ratti per rilevare la stabilità dei bio-NG in vivo. Li et al. quindi rimosso gli impianti dopo otto settimane e analizzato l'infiammazione per mostrare una buona biocompatibilità dei bio-NG per periodi di tempo prolungati in ambienti biologici senza effetti collaterali sistemici. I costrutti sono promettenti come impianti per la riparazione rigenerativa in vivo.
Stabilità in vivo e biocompatibilità dei bio-NG. Immagine chirurgica che mostra l'impianto dei bio-NG nel muscolo gastrocnemio (A) e nelle aree del nervo sciatico (B) di un topo. (C) Masson tricromica colorazione dei muscoli gastrocnemio nell'area impiantata. (D) Colorazione immunofluorescente con TNF-α del nervo sciatico nell'area impiantata. (E) Percentuale media di fibre di collagene nel tessuto muscolare misurata dalla colorazione di Masson. (F) Livello di espressione relativo di TNF-α misurato dalla colorazione immunofluorescente di TNF-α. (G) Colorazione H&E di organi vitali (fegato, cuore, polmone, rene, e cervello) alla settimana 8 dopo l'impianto nell'area del nervo sciatico. I dati sono espressi come valori medi ± DS. n =5. ***P <0,001. Credito fotografico:Tong Li, Università della Scienza e della Tecnologia di Nanchino. Credito:progressi scientifici, 10.1126/sciadv.abh2350 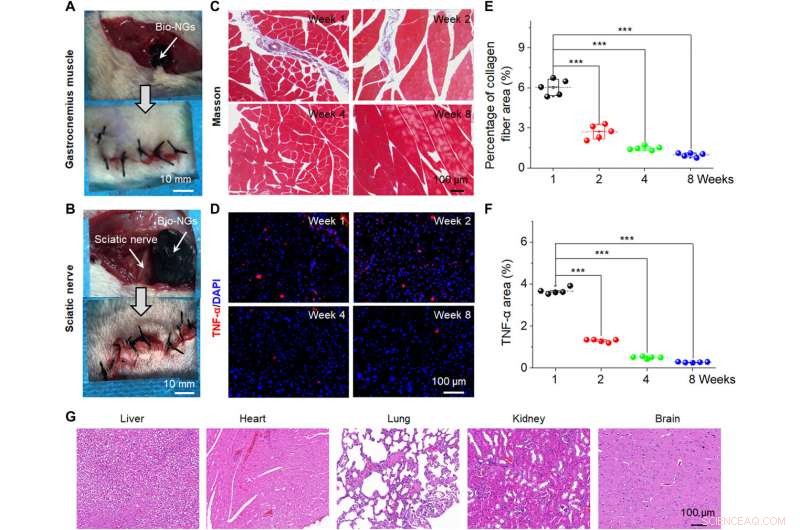
In questo modo, Tong Li e colleghi hanno sviluppato bio-nanogeneratori (bio-NG) di accoppiamento elettromeccanico simili a matrici extracellulari per regolare l'attività cellulare e mantenere la sua specifica espressione funzionale. The product created a local voltage potential to stimulate living cells as long as they remained motile. The unique environment facilitated cell culture in bio-NGs to trigger the opening of ion channels present in the cellular plasma membrane to achieve electrical stimulation at the single-cell level. The process offers great potential for bioelectronic medicine and cell-targeted local electrical impulses. The new method can replace inaccurate 2D systems and time-consuming animal models to provide a biomimetic, physiological microenvironment for accelerated tissue regeneration and bioinspired electronic medicine.
© 2021 Science X Network