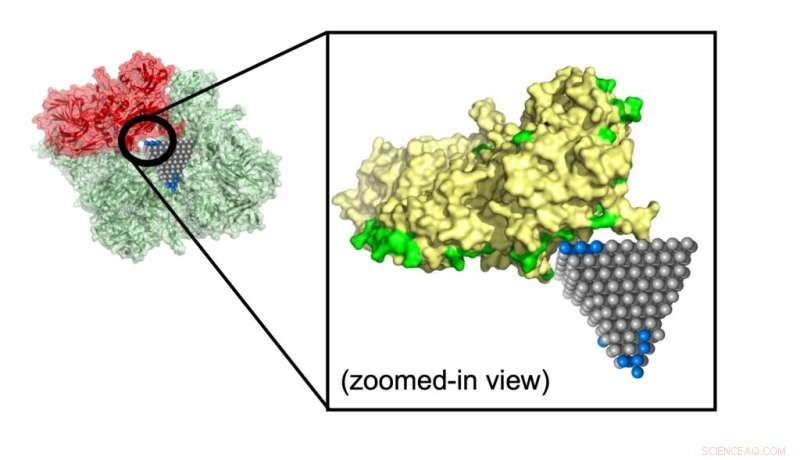
Il modello ha previsto come una nanopiramide di ossido di zinco interrompa una proteina che contribuisce al metabolismo nell'MRSA (Staphylococcus aureus resistente alla meticillina), un ceppo comune che causa infezioni resistenti agli antibiotici. Crediti:Minjeong Cha e Emine Sumeyra Turali Emre, Kotov Lab
Con le infezioni resistenti agli antibiotici in aumento e un virus pandemico in continua mutazione, è facile capire perché i ricercatori vogliono essere in grado di progettare nanoparticelle ingegnerizzate in grado di arrestare queste infezioni.
Un nuovo modello di apprendimento automatico che prevede le interazioni tra nanoparticelle e proteine, sviluppato presso l'Università del Michigan, ci avvicina a questa realtà.
"Abbiamo reimmaginato le nanoparticelle come qualcosa di più che semplici veicoli per la somministrazione di farmaci. Li consideriamo farmaci attivi in sé e per sé", ha affermato J. Scott VanEpps, assistente professore di medicina d'urgenza e autore dello studio in Nature Computational Scienza .
La scoperta dei farmaci è un processo lento e imprevedibile, motivo per cui così tanti antibiotici sono variazioni rispetto a un farmaco precedente. Gli sviluppatori di farmaci vorrebbero progettare medicinali in grado di attaccare batteri e virus nei modi che preferiscono, sfruttando i meccanismi "lock-and-key" che dominano le interazioni tra le molecole biologiche. Ma non era chiaro come passare dall'idea astratta di utilizzare le nanoparticelle per interrompere le infezioni all'attuazione pratica del concetto.
"Applicando metodi matematici alle interazioni proteina-proteina, abbiamo semplificato la progettazione di nanoparticelle che imitano una delle proteine in queste coppie", ha affermato Nicholas Kotov, professore di scienze chimiche e ingegneria della Irving Langmuir Distinguished University e autore corrispondente dello studio .
"Le nanoparticelle sono più stabili delle biomolecole e possono portare a classi completamente nuove di agenti antibatterici e antivirali."
Il nuovo algoritmo di apprendimento automatico confronta le nanoparticelle con le proteine utilizzando tre modi diversi per descriverle. Sebbene la prima fosse una descrizione chimica convenzionale, le due che riguardavano la struttura si sono rivelate le più importanti per fare previsioni sul fatto che una nanoparticella sarebbe stata una corrispondenza lock-and-key con una specifica proteina.
Tra di loro, queste due descrizioni strutturali hanno catturato la superficie complessa della proteina e il modo in cui potrebbe riconfigurarsi per consentire accoppiamenti lock-and-key. Ciò include le tasche in cui una nanoparticella potrebbe adattarsi, insieme alle dimensioni che tale nanoparticella dovrebbe avere. Le descrizioni includevano anche la chiralità, una rotazione in senso orario o antiorario importante per prevedere come si bloccheranno una proteina e una nanoparticella.
"Ci sono molte proteine all'esterno e all'interno dei batteri che possiamo prendere di mira. Possiamo usare questo modello come primo screening per scoprire quali nanoparticelle si legheranno con quali proteine", ha affermato Emine Sumeyra Turali Emre, ricercatrice post-dottorato in ingegneria chimica e co-first autore dell'articolo, insieme a Minjeong Cha, un Ph.D. studente in scienze dei materiali e ingegneria.
Emre e Cha hanno spiegato che i ricercatori potrebbero dare seguito alle corrispondenze identificate dal loro algoritmo con simulazioni ed esperimenti più dettagliati. Una di queste corrispondenze potrebbe fermare la diffusione dell'MRSA, un comune ceppo resistente agli antibiotici, utilizzando nanopiramidi di ossido di zinco che bloccano gli enzimi metabolici nei batteri.
"Algoritmi di apprendimento automatico come il nostro forniranno uno strumento di progettazione per nanoparticelle che possono essere utilizzate in molti processi biologici. L'inibizione del virus che causa COVID-19 è un buon esempio", ha affermato Cha. "Possiamo utilizzare questo algoritmo per progettare in modo efficiente nanoparticelle con attività antivirale ad ampio spettro contro tutte le varianti".
Questa svolta è stata consentita dalla Blue Sky Initiative presso l'UM College of Engineering, che ha fornito supporto al team interdisciplinare che ha svolto l'esplorazione fondamentale dell'efficacia di un approccio di apprendimento automatico quando i dati sull'attività biologica delle nanoparticelle sono così scarsi.
"Il nucleo dell'idea di Blue Sky è esattamente ciò che copre questo lavoro:trovare un modo per rappresentare proteine e nanoparticelle in un approccio unificato per comprendere e progettare nuove classi di farmaci che hanno molteplici modi di agire contro i batteri", ha affermato Angela Violi, un Arthur F. Thurnau Professor, professore di ingegneria meccanica e leader del progetto Blue Sky di nanobiotici.
Anche i collaboratori dell'Università della California, Los Angeles, hanno contribuito all'algoritmo di apprendimento automatico. + Esplora ulteriormente