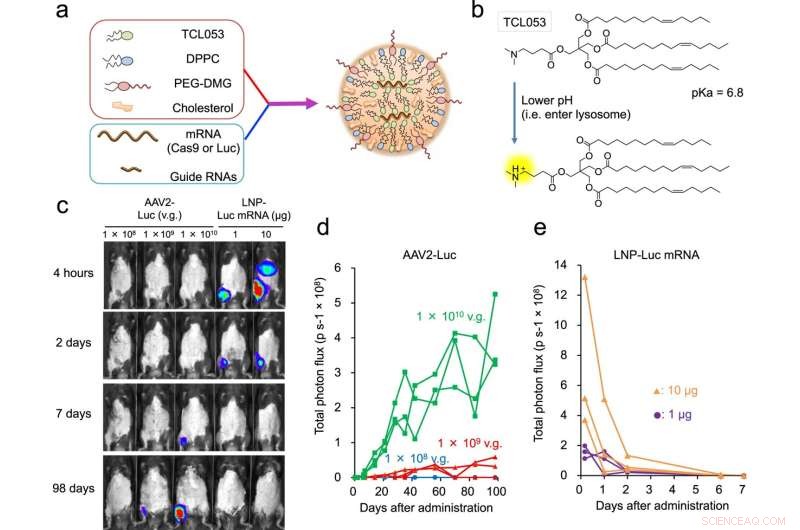
Fig. 1:Consegna di mRNA/sgRNA di Luc-mRNA o CRISPR-Cas9 mediata da LNP nel tessuto muscolare. un'illustrazione schematica di LNP-CRISPR. L'mRNA di Luc o l'mRNA/sgRNA di Cas9 sono incapsulati in LNP che consiste in TCL053, DPPC (Dipalmitoilfosfatidilcolina), PEG-DMG (polietilenglicole-dimiristoilglicerolo) e colesterolo. b Struttura chimica del lipide ionizzabile di nuova sintesi, TCL053. c Immagini rappresentative di bioluminescenza di topi C57BL/6J dopo l'iniezione intramuscolare di AAV2-Luc (1 × 108, 1 × 109 o 1 × 1010 v.g., genomi vettoriali) o LNP-Luc mRNA (1 o 10 μg di mRNA). d, e Quantificazione del segnale di bioluminescenza nel muscolo scheletrico di topi C57BL/6J trattati con mRNA AAV2-Luc (d) o LNP-Luc (e). Gli stessi topi (n = 3 topi per gruppo) sono stati esaminati ripetutamente nel tempo. I dati del flusso totale (p s−1, fotoni al secondo) vengono tracciati come una singola riga per mouse. Credito:DOI:10.1038/s41467-021-26714-w
Molte malattie intrattabili sono il risultato di una mutazione genetica. La tecnologia di editing del genoma promette di correggere la mutazione e quindi nuovi trattamenti per i pazienti. Tuttavia, portare la tecnologia alle cellule che necessitano della correzione rimane una sfida importante. Un nuovo studio condotto dal Professore Associato Junior CiRA Akitsu Hotta e in collaborazione con Takeda Pharmaceutical Company Limited nell'ambito del programma di ricerca congiunto T-CiRA, riporta come le nanoparticelle lipidiche forniscano un mezzo efficace per il trattamento della distrofia muscolare di Duchenne (DMD) nei topi .
Il premio Nobel per la chimica dell'anno scorso agli scopritori di CRISPR-Cas9 ha cementato l'impatto della tecnologia di modifica del genoma. Mentre CRISPR-Cas9 può essere applicato all'agricoltura e al bestiame per cibo più nutriente e colture robuste, la maggior parte dell'attenzione dei media è sul suo potenziale medico. La DMD è solo una delle tante malattie per le quali i ricercatori prevedono un trattamento utilizzando CRISPR-Cas9.
"I farmaci oligonucleotidici sono ora disponibili per la DMD, ma i loro effetti sono transitori, quindi il paziente deve sottoporsi a trattamenti settimanali. D'altra parte, gli effetti di CRISPR-Cas9 sono di lunga durata", ha affermato Hotta.
La DMD provoca atrofia muscolare progressiva in tutto il corpo. I pazienti normalmente iniziano a mostrare sintomi, come cadere facilmente e l'incapacità di correre prima dell'età scolare, e spesso indossano respiratori prima dell'età adulta.
Per una malattia come la DMD, è necessario prendere di mira un'ampia gamma di muscoli scheletrici, il che significa che le iniezioni multiple sono importanti. I sistemi di somministrazione attualmente studiati utilizzano virus non patogeni per fornire CRISPR-Cas9, ma questi virus inducono reazioni immunitarie e la produzione di anticorpi, che vietano iniezioni multiple.
Le nanoparticelle lipidiche possono prevenire queste reazioni. Come suggerisce il nome, le nanoparticelle lipidiche sono minuscole particelle di diametro inferiore a 0,1 µm e costituite da lipidi che cambiano le loro proprietà in risposta all'acidità. Questa caratteristica consente loro di rimanere intatti all'esterno della cellula, ma una volta all'interno si rompono per rilasciare il loro contenuto, come CRISPR-Cas9, che è quindi libero di correggere la mutazione genetica. Le nanoparticelle lipidiche vengono utilizzate per i vaccini COVID-19, ma la loro utilità per la terapia di modifica del genoma è ancora oggetto di studio. Nell'ambito del programma di ricerca congiunto T-CiRA, Hotta ha sviluppato nanoparticelle lipidiche in grado di fornire alla cellula una tecnologia di modifica del genoma.
Dopo aver sperimentato diverse formulazioni, lo studio riporta una nuova nanoparticella lipidica che incapsula CRISPR-Cas9 all'interno e prende di mira le cellule muscolari nei topi.
A differenza dei farmaci oligonucleotidici, i cui effetti nei topi sono costantemente diminuiti dopo il trattamento e sono scomparsi dopo alcuni mesi, lo studio mostra che la somministrazione di CRISPR-Cas9 con la nuova nanoparticella lipidica ha sostenuto un effetto costante nei muscoli che è durato oltre un anno.
Inoltre, gli effetti erano evidenti anche durante la somministrazione delle particelle con più iniezioni intramuscolari, mentre la somministrazione basata sul virus non ha avuto effetto dopo la seconda iniezione. Inoltre, le nanoparticelle lipidiche perfuse per via endovenosa negli arti hanno avuto benefici terapeutici su più tessuti muscolari.
Aggiungendo alla sicurezza, Hotta ha osservato:"CRISPR-Cas9 è scomparso dal corpo in pochi giorni. Ciò significa che il rischio di una modifica del genoma fuori bersaglio è minimo, ma gli effetti terapeutici durano a lungo". + Esplora ulteriormente