I ricercatori hanno creato una "porta logica" simile a un transistor, che è un tipo di operazione computazionale in cui più input controllano un output e lo incorporano in una proteina. Hanno scoperto che non solo potevano attivare rapidamente la proteina usando la luce e il farmaco rapamicina, ma anche che questa attivazione portava le cellule a subire cambiamenti interni che miglioravano le loro capacità adesive, che alla fine diminuivano la loro motilità. Credito:Penn State
La creazione di computer su scala nanometrica da utilizzare nell'assistenza sanitaria di precisione è stata a lungo il sogno di molti scienziati e operatori sanitari. Ora, per la prima volta, i ricercatori della Penn State hanno prodotto un agente di nanocomputer in grado di controllare la funzione di una particolare proteina coinvolta nel movimento cellulare e nelle metastasi del cancro. La ricerca apre la strada alla costruzione di complessi computer su nanoscala per la prevenzione e la cura del cancro e di altre malattie.
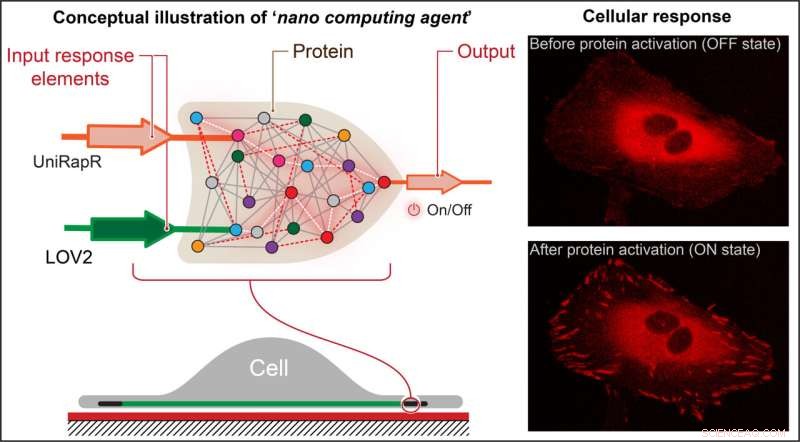
Nikolay Dokholyan, G. Thomas Passananti Professor, Penn State College of Medicine, e i suoi colleghi, tra cui Yashavantha Vishweshwaraiah, studioso post-dottorato in farmacologia, Penn State, hanno creato una "porta logica" simile a un transistor, che è un tipo di operazione computazionale in cui più ingressi controllano un'uscita.
"La nostra porta logica è solo l'inizio di ciò che si potrebbe chiamare informatica cellulare", ha affermato, "ma è una pietra miliare importante perché dimostra la capacità di incorporare operazioni condizionali in una proteina e controllarne la funzione", ha affermato Dokholyan. ci consentono di acquisire una comprensione più profonda della biologia e delle malattie umane e introduce possibilità per lo sviluppo di terapie di precisione."
La porta logica del team comprendeva due domini sensori progettati per rispondere a due input:la luce e il farmaco rapamicina. Il team ha preso di mira la chinasi di adesione focale della proteina (FAK) perché è coinvolta nell'adesione e nel movimento cellulare, che sono i primi passi nello sviluppo del cancro metastatico.
"In primo luogo, abbiamo introdotto un dominio sensibile alla rapamicina, chiamato uniRapr, che il laboratorio aveva precedentemente progettato e studiato, nel gene che codifica per FAK", ha affermato Vishweshwaraiah. "Successivamente, abbiamo introdotto il dominio, LOV2, che è sensibile alla luce. Dopo aver ottimizzato entrambi i domini, li abbiamo combinati in un unico progetto di porta logica."
Il team ha inserito il gene modificato nelle cellule tumorali HeLa e, utilizzando la microscopia confocale, ha osservato le cellule in vitro. Hanno studiato gli effetti di ciascuno degli input separatamente, nonché gli effetti combinati degli input, sul comportamento delle cellule.
Hanno scoperto che non solo potevano attivare rapidamente FAK usando luce e rapamicina, ma anche che questa attivazione portava le cellule a subire cambiamenti interni che miglioravano le loro capacità adesive, che alla fine diminuivano la loro motilità.
I loro risultati sono stati pubblicati oggi (16 novembre) sulla rivista Nature Communications .
"Mostriamo per la prima volta che possiamo costruire un agente di nanocomputer funzionante all'interno delle cellule viventi in grado di controllare il comportamento cellulare", ha affermato Vishweshwaraiah. "Abbiamo anche scoperto alcune caratteristiche interessanti della proteina FAK, come i cambiamenti che innesca nelle cellule quando viene attivata."
Dokholyan ha osservato che il team spera di testare questi agenti di nanocomputer in vivo all'interno degli organismi viventi.
Altri autori della Penn State sulla carta includono Jiaxing Chen, studente laureato; Venkat R. Chirasani, borsista post-dottorato; ed Erdem D. Tabdanov, assistente professore di farmacologia. + Esplora ulteriormente