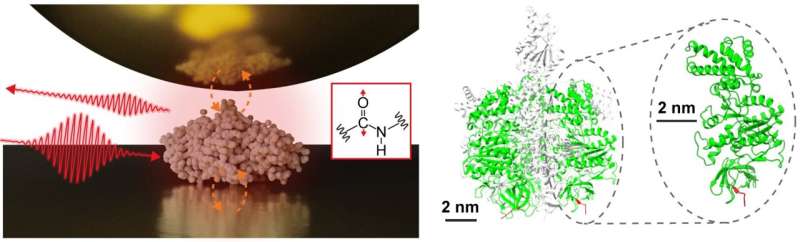
Un gruppo di ricerca interdisciplinare, guidato dal Prof. Assistente Jun Nishida e dal Prof. Associato Takashi Kumagai presso l'Istituto di Scienze Molecolari, ha osservato con successo gli spettri vibrazionali di singole proteine, costituite da circa 500 residui di amminoacidi, utilizzando tecniche di misurazione avanzate basate su quasi- microscopia ottica da campo. Questo metodo utilizza la luce confinata su scala nanometrica, consentendo l'analisi dettagliata di campioni estremamente piccoli, cosa che in precedenza era problematica con la spettroscopia a infrarossi convenzionale.
Lo studio è pubblicato sulla rivista Nano Letters .
La spettroscopia infrarossa convenzionale è stata ampiamente utilizzata per l'analisi strutturale e chimica di vari materiali poiché può misurare gli spettri vibrazionali, spesso definiti "impronte molecolari".
Il nuovo risultato rappresenta un importante progresso verso innovazioni tecnologiche come l'imaging a infrarossi ultrasensibile e ad alta risoluzione, nonché la spettroscopia vibrazionale a singola molecola.
Il rapido sviluppo delle nanotecnologie negli ultimi anni ha portato a una crescente domanda di imaging a infrarossi ad altissima sensibilità e super risoluzione. Tuttavia, la spettroscopia infrarossa convenzionale è limitata nella misurazione di campioni estremamente piccoli o nel raggiungimento di una risoluzione spaziale su scala nanometrica. Ad esempio, anche la microspettroscopia a infrarossi con una buona sensibilità richiede oltre un milione di proteine per ottenere uno spettro infrarosso, rendendo impossibile misurare una sola proteina.
Nel loro studio, il gruppo di ricerca ha isolato una singola proteina, una subunità comprendente un complesso proteico chiamato F1 -ATPasi, su un substrato d'oro e ha eseguito misurazioni di spettroscopia infrarossa in campo vicino in un ambiente ambientale.
Hanno acquisito con successo lo spettro vibrazionale infrarosso di una singola proteina, rappresentando un importante progresso che potrebbe portare alla caratterizzazione delle organizzazioni strutturali locali delle singole proteine. Tali informazioni sono particolarmente importanti per comprendere le funzioni sofisticate dei complessi proteici e delle proteine di membrana, poiché offrono informazioni più approfondite sui loro meccanismi e sulle loro interazioni.
Inoltre, hanno sviluppato un nuovo quadro teorico che descrive le interazioni su scala nanometrica tra il campo vicino dell'infrarosso e le proteine.
Sulla base della teoria, il team è stato in grado di riprodurre quantitativamente gli spettri vibrazionali sperimentali osservati. Questi risultati saranno preziosi per l'analisi chimica delle biomolecole e di vari nanomateriali, aprendo la strada a una serie di applicazioni della spettroscopia infrarossa su scala nanometrica.
Ulteriori informazioni: Jun Nishida et al, Interazioni del campo vicino al raggio sub-punta nella spettroscopia vibrazionale nano-FTIR su singole proteine, Nano lettere (2024). DOI:10.1021/acs.nanolett.3c03479
Informazioni sul giornale: Nanolettere
Fornito da National Institutes of Natural Sciences