Un nuovo studio condotto da pre-Ph.D. il ricercatore Pablo S. Valera dimostra il potenziale della spettroscopia Raman con miglioramento della superficie (SERS) per esplorare i metaboliti secreti dalle cellule tumorali nella ricerca sul cancro.
Lo studio, condotto dai professori di ricerca di Ikerbasque Luis Liz-Marzán (del CIC biomaGUNE) e Arkaitz Carracedo (del CIC bioGUNE) e al quale hanno partecipato altri ricercatori di entrambi i centri, anche membri del Networking Biomedical Research Center (CIBER). inoltre, fornisce preziose informazioni per guidare esperimenti più specifici per rivelare la funzione di tali metaboliti secreti nel microambiente o ambiente tumorale, che potrebbero portare a nuove strategie terapeutiche.
Il lavoro è pubblicato sulla rivista Proceedings of the National Academy of Sciences .
Il microambiente tumorale è un ecosistema complesso formato dalle interazioni tra tumore e cellule sane. È uno pseudoorgano dinamico che determina lo sviluppo e la progressione dei tumori. Sebbene l'attenzione si sia tradizionalmente concentrata sulla comunicazione intercellulare mediata da messaggeri proteici, recentemente l'attenzione si è rivolta ai metaboliti (o piccoli composti) secreti dai tumori nello spazio extracellulare.
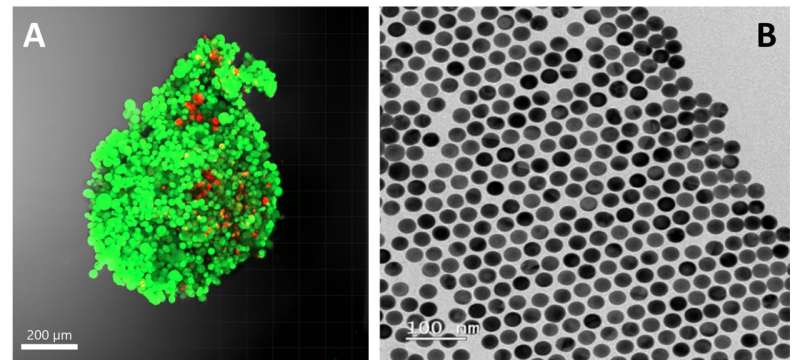
Le tecniche tradizionali per tracciare questi metaboliti in contesti cellulari complessi sono limitate, ma la spettroscopia Raman con miglioramento della superficie (SERS) è emersa come un'alternativa promettente grazie alla sua semplicità di funzionamento.
In questo studio, una strategia basata sul SERS propone di "investigare i metaboliti secreti dalle cellule tumorali prive di metiltioadenosina fosforilasi (un evento genetico comune associato a prognosi sfavorevole in vari tipi di cancro, come il cancro al seno e il glioblastoma)", ha spiegato Valera. La SERS "è una tecnica spettroscopica che utilizza nanoparticelle d'oro per rilevare le molecole in un biofluido. È una tecnica abbastanza veloce, in cui non è richiesto alcun pretrattamento dei campioni", ha aggiunto.
Utilizzando la SERS, i ricercatori hanno scoperto che queste cellule secernono metaboliti purinici, che possono essere metabolizzati dalle cellule sane, dando origine a cambiamenti molecolari coerenti con l'aggressività del cancro; questo spiega la riprogrammazione, mai vista prima, dell'ambiente tumorale nei tumori con soppressione della metiltioadenosina fosforilasi.
"Siamo stati in grado di rilevare questo metabolita, non solo nelle cellule tumorali ma anche nel resto delle cellule sane che sono in contatto con le cellule tumorali. Quindi abbiamo scoperto che esiste una relazione tra le cellule tumorali e le cellule sane attraverso questo metabolita, e che provoca anche un cambiamento nel comportamento delle cellule sane in modo che in una certa misura aiutino lo sviluppo del tumore," ha detto Valera.
Vale la pena sottolineare che "svelare la complessità di tali interazioni nei pazienti affetti da cancro potrebbe, a sua volta, aprire la strada a nuovi approcci terapeutici", ha aggiunto.
L’applicazione riuscita della SERS in questo studio dimostra che questa tecnologia potrebbe accelerare la capacità di catturare rapidamente le interazioni metaboliche in ambienti complessi. Infatti, la semplice e rapida acquisizione dei segnali in SERS, insieme alla sua elevata sensibilità, soddisfa i requisiti per essere uno strumento di prima linea in grado successivamente di guidare analisi più specifiche.
Un quadro completo dello stato metabolico del microambiente tumorale può essere ottenuto monitorando con tecniche complementari. È anche importante evidenziare che è stata dimostrata un'efficace sinergia tra SERS e altri metodi analitici.
Ulteriori informazioni: Pablo S. Valera et al, l'analisi SERS delle purine secrete dalle cellule tumorali rivela un'interferenza paracrina unica nei tumori con deficit di MTAP, Atti dell'Accademia Nazionale delle Scienze (2023). DOI:10.1073/pnas.2311674120. doi.org/10.1073/pnas.2311674120
Informazioni sul giornale: Atti dell'Accademia Nazionale delle Scienze
Fornito da Elhuyar Fundazioa