I pazienti alle prese con alcune malattie croniche spesso devono attendere anni per una diagnosi corretta. Ad esempio, sintomi come la mancanza di respiro possono essere attribuiti a molti disturbi polmonari e cardiovascolari, quindi i pazienti possono essere trattati per una malattia diagnosticata erroneamente che è lontana da una diagnosi e da un trattamento accurati.
Pertanto, uno dei metodi più promettenti per affrontare questo problema è monitorare i livelli di composti specifici nel corpo durante lo sviluppo di una malattia specifica. Muovendosi in questa direzione, gli scienziati dell'Istituto di Chimica Fisica dell'Accademia Polacca delle Scienze (Varsavia, Polonia) e dell'Università Nazionale di Kaohsiung a Kaohsiung (Kaohsiung, Taiwan) hanno presentato le loro ricerche sullo sviluppo di un metodo per la diagnosi rapida ed efficace di una malattia letale malattia polmonare.
La fibrosi polmonare idiopatica (IPF) è una malattia cronica che causa fibrosi polmonare con esiti fatali, che portano al soffocamento. I suoi sintomi più comuni sono tosse secca e mancanza di respiro, che possono essere associati a molteplici disturbi. Pertanto, spesso può essere diagnosticata erroneamente come molte malattie diverse, rendendo la diagnosi accurata lunga e ardua, con un impatto drammatico sulla qualità della vita di un paziente.
Inoltre, i sintomi possono essere ritardati finché non è troppo tardi per trattare il paziente con successo. Lo sviluppo dell’IPF è ancora un mistero medico. Pertanto, vi è un’enorme necessità di una diagnosi precoce dell’IPF. Il rilevamento elettrochimico dei biomarcatori dell’IPF è una delle soluzioni. I biomarcatori sono composti specifici, ad esempio proteine, acidi nucleici o altri composti prodotti in modo anomalo dall’organismo durante lo sviluppo della malattia. Per l'IPF si possono distinguere diversi biomarcatori.
Uno di questi è la metalloproteinasi-1 della matrice (MMP-1), che degrada i collageni fibrillari nel tratto respiratorio. Nonostante le ben note proprietà chimiche dell'MMP-1, il monitoraggio rapido di questo biomarcatore nei fluidi corporei come parte della progressione dell'IPF è oggi ben lungi dall'essere una diagnosi da sogno.
Recentemente, i ricercatori dell’Istituto di Chimica Fisica dell’Accademia Polacca delle Scienze (IPC PAS) di Varsavia (Polonia), in collaborazione con scienziati del Dipartimento di Ingegneria Chimica e dei Materiali dell’Università Nazionale di Kaohsiung di Kaohsiung (Taiwan), hanno preso di mira monitorare l'IPF e una diagnostica rapida ideando un nuovo chemosensore elettrochimico per la determinazione selettiva, rapida ed efficiente del biomarcatore dell'IPF, in particolare MMP-1.
Per preparare questo chemosensore, i ricercatori si sono affidati all’imprinting molecolare nei polimeri, una tecnica basata sulla miscelazione di un monomero funzionale, un agente reticolante e un modello, seguita dalla generazione di una matrice polimerica che forma cavità molecolari a forma di (molecola modello) corrispondenti una chiave molecolare che si inserisce nella serratura polimerica.
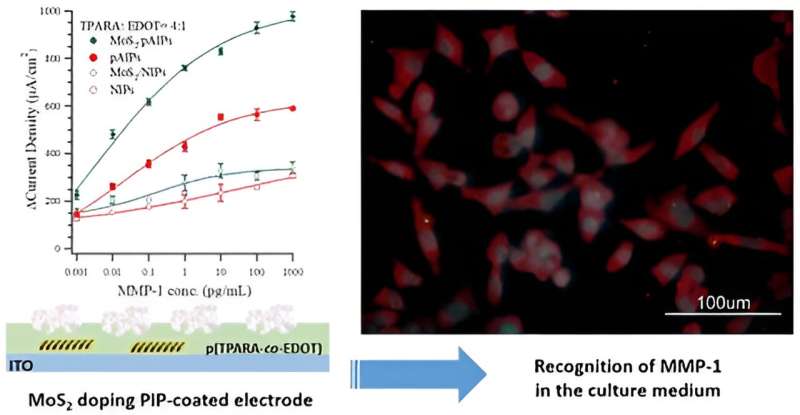
Nello specifico, hanno modificato l'elettrodo trasparente (un vetrino rivestito con l'ossido conduttore di indio-stagno chiamato ITO) con un polimero a impronta molecolare (MIP), poli (TPARA-co-EDOT), costituito da due monomeri, EDOT e TPARA. Inoltre, drogato con un MoS2 -Materiale traballante 2D, il MIP è stato modellato con l'epitopo peptidico del biomarcatore della proteina MMP-1.
Quindi, questo stampo è stato rimosso dal MIP, lasciando cavità molecolari di forma e dimensione caratteristiche delle molecole di epitopo peptidico utilizzate per l'imprinting. Poiché le cavità corrispondono a queste caratteristiche molecole peptidiche, il MIP può essere facilmente utilizzato per determinare la molecola corrispondente. Curiosamente, drogando il MIP con MoS2 migliorato significativamente il limite di rilevamento dell'MMP-1 rispetto al MIP non drogato.
Il Dr. Piyush S. Sharma afferma:"L'incorporazione di nuovi materiali nei chemosensori elettrochimici può migliorare le loro prestazioni e aiutare a chiarire il loro meccanismo di rilevamento. Nella nostra ricerca, il MIP basato su (epitopo peptidico) è stato drogato con MoS2 scaglie con una dimensione media di 0,6−1,5 μm durante la sua deposizione come film sottile su un elettrodo ITO. In sostanza, questo doping ha raddoppiato la risposta elettrochimica (sopra lo sfondo) al biomarcatore della proteina MMP-1 bersaglio."
La macromolecola MMP-1 ha diversi peptidi situati ai suoi bordi, i cosiddetti epitopi, riconosciuti dal sistema immunitario. Questi epitopi possono essere impiegati con successo come impronta nei chemosensori elettrochimici MIP. Poiché l'imprinting delle proteine non avrebbe portato alla loro determinazione con successo, portando a grandi cavità che si adattano a molti composti di molecole più piccole, le molecole impresse erano di epitopo peptidico, molto più piccole delle proteine.
Inoltre, oltre alle loro dimensioni più piccole, i peptidi sono più stabili delle proteine in condizioni sperimentali, compreso l’utilizzo di un solvente organico durante la formazione di una pellicola polimerica sulla superficie dell’elettrodo. Vale la pena ricordare che utilizzando MoS2 i fiocchi consentono il rilevamento del biomarcatore MMP-1 e, quindi, della fibrosi polmonare idiopatica.
"La MoS2 Le prestazioni degli elettrodi rivestiti con film pAIP drogati sono paragonabili a quelle della letteratura recente. Infine, l'elettrodo è stato utilizzato per determinare l'MMP-1 nei terreni di coltura delle cellule HEK293T geneticamente modificate e, rispetto a un test ELISA commerciale, la sua precisione era elevata," osserva il prof. Włodzimierz Kutner.
Questa ricerca, dettagliata in ACS Applied Nano Materials , è promettente per il monitoraggio dello sviluppo di malattie croniche e progressive di eziologia e patogenesi sconosciute, inclusa la fibrosi polmonare idiopatica.
C’è ancora spazio per testare il rilevamento in condizioni dirompenti, ma si spera che l’imprinting molecolare nei polimeri otterrà maggiore attenzione e applicazione in biomedicina, avvicinando la società a una diagnosi rapida e accurata di molte malattie impegnative. I ricercatori sperano che il loro concetto collaudato di un chemosensore elettrochimico a impronta molecolare possa essere adattato anche ad altre malattie e alla medicina personalizzata.
Ulteriori informazioni: Mei-Hwa Lee et al, MoS2 Elettrodi rivestiti con polimeri impressi con peptidi drogati con nanosheet per la determinazione elettrochimica dell'espressione di proteine attivate da CRISPR/dCas9, nanomateriali applicati ACS (2023). DOI:10.1021/acsanm.3c04130
Fornito dall'Accademia Polacca delle Scienze