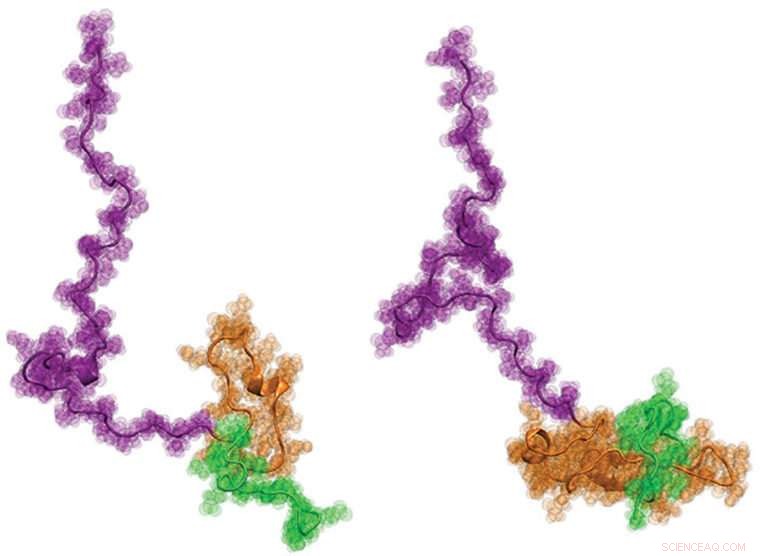
Una coorte internazionale di scienziati, inclusi ingegneri della Washington University di St. Louis, recentemente visualizzato per la prima volta la proteina di Huntington. Si spera che saperne di più sulla struttura, che ha una forma simile a un girino, possa aiutare a informare meglio lo sviluppo di nuove terapie per la malattia. Credito:Washington University di St. Louis
La malattia di Huntington è progressiva, malattia neurodegenerativa fatale causata da mutazioni in un gene specifico chiamato huntingtina (Htt). Negli oltre 20 anni da quando è stato identificato il gene Htt, i ricercatori si sono concentrati sulla proteina codificata dal gene Htt, chiamato Httex1. Questa proteina si accumula nel cervello dei pazienti con malattia di Huntington, e l'ipotesi prevalente è che subisca un drammatico cambiamento strutturale quando un tratto ripetitivo dell'amminoacido glutammina muta in una regione aberrantemente lunga nota come tratto della poliglutammina espansa per mutazione (polyQ).
Ora, per la prima volta, il team di Hilal A. Lashuel dell'Ècole Polytechnique Fèdèrale de Lausanne (EPFL) in Svizzera; Edward A. Lemke presso il Laboratorio europeo di biologia molecolare (EMBL) in Germania; e Rohit V. Pappu alla Washington University di St. Louis ha scoperto una descrizione strutturale dettagliata di Htt in funzione della lunghezza di polyQ. L'opera è stata pubblicata di recente su Giornale della Società Chimica Americana .
Uno studio in tre fasi
Garantire descrizioni strutturali a livello atomico di Htt a lunghezza intera e frammenti proteici rilevanti per la malattia indicati come Httex1 è stato difficile perché queste molecole si attaccano l'una all'altra e inibiscono la generazione di campioni di proteine pure per studi strutturali. "È molto difficile ottenere la caratterizzazione strutturale delle proteine all'interno di una poltiglia, " disse Pappo, l'Edwin H. Murty Professor of Engineering presso la School of Engineering &Applied Science.
"Il nostro obiettivo era quello di ottenere informazioni su come l'aumento della lunghezza della ripetizione della coda polyQ altera la struttura di questa proteina a livello di monomero e in condizioni in cui siamo in grado di scollegare il suo ripiegamento e autoassemblaggio, " disse Lashuel, professore di scienze della vita e direttore del laboratorio di biologia chimica della neurodegenerazione all'EPFL.
Nella prima fase dello studio, Lashuel e il borsista post-dottorato John B. Warner IV hanno utilizzato nuove strategie chimiche nel loro laboratorio per produrre precisi, campioni di elevata purezza di Htt per spettroscopia molecolare. Ma questi arrivavano solo in concentrazioni ultra basse e richiedevano tecniche che sondassero le singole molecole. Warner e Lashuel hanno consentito questi esperimenti generando campioni con etichette fluorescenti specifiche del sito.
Per la seconda fase del progetto, Warner e Lashuel hanno lavorato con il laboratorio di Lemke all'EMBL per eseguire il trasferimento di energia di risonanza di Förster (o fluorescenza) a singola molecola (smFRET), che è una tecnica in grado di misurare distanze tra 1-10 nanometri all'interno di singole molecole, in questo caso, all'interno delle singole proteine Htt. Questa parte dello studio ha prodotto la prima valutazione quantitativa di come le distanze interatomiche all'interno di Httex1 variano con le mutazioni di espansione.
Finalmente, gli scienziati hanno lavorato con il laboratorio di Pappu alla Washington University, dove ha sviluppato nuovi approcci di modellazione al computer per produrre fisicamente accurati, modelli strutturali a livello atomico di Httex1 che meglio si adattano a tutti i dati di singole molecole dei due passaggi precedenti. I risultati sono stati sorprendenti:la struttura complessiva di Httex1 assomiglia a quella di un girino.
L'effetto girino
"Architettonicamente, Httex1 è a forma di girino, con una testa globulare polyQ e una coda floscia, "Ha detto Pappu. "Man mano che la lunghezza del polyQ si allunga, la testa del girino diventa più grande nella sua superficie. Questa maggiore superficie della testa sembra generare interazioni che altrimenti non dovrebbero essere presenti nelle cellule".
La scoperta sfida le idee di vecchia data sull'accumulo di Httex1 nella malattia di Huntington. "Se l'ipotesi prevalente fosse vera, "Pappo ha detto "allora il girino si sarebbe trasformato in una 'rana' man mano che la lunghezza del polyQ aumentava al di sopra della lunghezza della soglia, ma non sembra essere così. I nuovi risultati focalizzano invece la nostra attenzione sulle nuove interazioni cellulari con guadagno di funzione che sono guidate dalla struttura del girino con una testa polyQ più grande".
"Mentre l'ipotesi prevalente ha favorito un modello in cui la tossicità indotta dall'huntingtina mutante è guidata principalmente dalla sua propensione a ripiegarsi male e ad aggregarsi, i nostri risultati suggeriscono che anche le interazioni aberranti a livello dei monomeri possono contribuire all'inizio e/o alla progressione della malattia, " disse Lashuel.
"Questa scoperta ci consente di esaminare quali regioni di questa proteina sono importanti da colpire, e modulare la sua tossicità in modo specifico, " ha detto Kiersten M. Ruff, un borsista post-dottorato nel laboratorio di Pappu che ha progettato le simulazioni al computer ed è il co-primo autore del documento.
La prossima sfida per gli scienziati è capire come questi cambiamenti strutturali a livello di monomero di Httex1 si traducano in un aumento dell'aggregazione e della tossicità quando la lunghezza della coda polyQ supera la soglia patogena.
"La chiave è stata la centralità della collaborazione tra tre team con competenze complementari e non sovrapponibili, tutti condividono l'impegno a far progredire la scienza, " disse Lashuel.