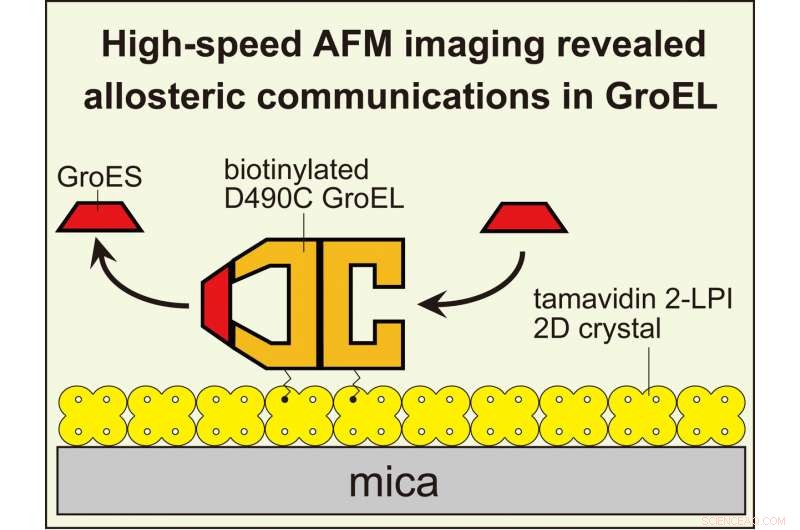
L'imaging HS-AFM ha rivelato comunicazioni allosteriche tra gli anelli in GroEL che regolano la sua reazione chaperonin. Per visualizzare le interazioni dinamiche GroEL-GroES con AFM ad alta velocità, GroEL biotinilato nei suoi domini equatoriali è stato legato al cristallo bidimensionale di tamavidina 2-LPI formato direttamente sulla superficie della mica. Credito:Università di Kanazawa
Le proteine devono ripiegarsi in un modo specifico per funzionare. Questo è spesso assistito da chaperon molecolari, piccole proteine il cui compito è aiutare gli altri a piegarsi nella giusta forma. Ora, Ricercatori giapponesi hanno scoperto che almeno per un chaperone molecolare, c'è di più nel processo di quanto si sospettasse.
In un giornale in Transazioni filosofiche della Royal Society , il gruppo guidato da Kanazawa si è concentrato su GroEL, che è vitale per il ripiegamento delle proteine nei batteri. Lo schema di massima è compreso:GroEL cattura una proteina bersaglio non ripiegata (il substrato) all'interno di una cavità, dove può piegarsi correttamente senza aggregarsi. Però, i dettagli meccanicistici sono difficili da svelare con i metodi tradizionali dell'ensemble. Nel nuovo studio, La microscopia a forza atomica ad alta velocità (HS-AFM) è stata utilizzata per visualizzare gli eventi in modo più diretto.
GroEL è una molecola a forma di cilindro, composto da due anelli impilati uno contro l'altro. Un partner chiave nella sua funzione è GroES, una "co-chaperonin" a forma di anello che si lega a ciascuna estremità di GroEL come un coperchio a cupola. Solo quando GroEL è ricoperto da GroES può intrappolare la proteina del substrato. Quindi, quando la piegatura è completa, GroES si dissocia da GroEL, e il substrato piegato viene rilasciato.
Dove diventa nebuloso è come cooperano i due anelli alle due estremità di GroEL. Gli anelli sono identici, ed entrambi possono essere coperti da GroES. Quando solo un'estremità è chiusa, il complesso risultante è chiamato "proiettile", in virtù del suo aspetto appuntito. Nel frattempo, il modulo con entrambe le estremità chiuse è soprannominato "calcio", poiché la sua forma ovale simmetrica ricorda una palla di graticola.

Eventi di associazione e dissociazione GroES catturati dall'imaging HS-AFM. Sebbene la reazione proceda principalmente in modo alternativo come B? ? F ? B? ? F (B e F rappresentano complessi di proiettili e calcio, rispettivamente, e le frecce verticali indicano la polarità dei complessi di proiettili), a volte si verifica in modi diversi. Credito:Università di Kanazawa
"In un modello convenzionale, il ciclo di tappatura, ripiegamento delle proteine, e stappando si alterna tra ogni anello, ", afferma il coautore dello studio Daisuke Noshiro. "Il capping su un anello di GroEL (che ha stereochimica cis) impedisce il capping simultaneo all'altra estremità (trans). Tale comunicazione intramolecolare è nota come allosteria." In questa prospettiva, il proiettile a tappo singolo è la forma attiva di GroEL, e il calcio è solo un intermedio di breve durata tra i cicli.
Altri risultati, anche se, hanno suggerito una maggiore complessità, che è stata evidenziata da questo nuovo studio. A seconda del tipo di supporto, GroEL è apparso come un calcio, piuttosto che un proiettile, fino al 67% delle volte, implicando una rottura della regolazione allosterica negativa. Questo era più comune quando il substrato era una proteina non ripiegabile o non c'era alcun substrato, ma anche con supporti pieghevoli, complessi di calcio abbondavano.
Più inaspettatamente, il ciclo si è verificato per due percorsi diversi. Nel tipo predominante I, quando l'anello attivo di GroEL completa il suo compito e l'altra estremità prende il testimone, i due anelli si scambiano anche conformazioni cis e trans. Però, circa il 25% delle volte (nel tipo II), le conformazioni non si scambiano, interrompendo la circolare, ritmo alternato di Tipo I. Tuttavia, si verifica ancora il ripiegamento delle proteine. I palloni sono prevalenti in entrambi i casi.
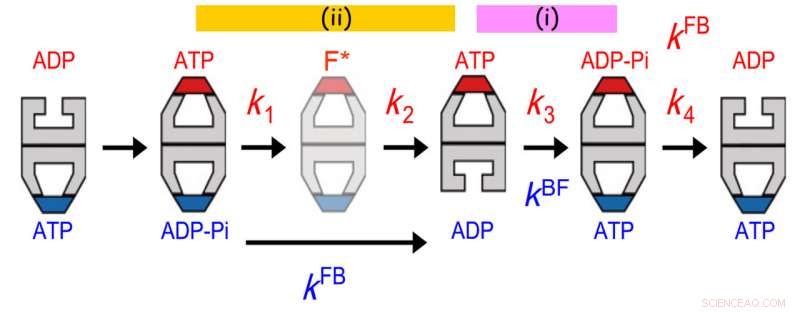
Comunicazioni allosteriche tra due anelli di GroEL. La distribuzione della durata di GroES legata è stata adattata al meglio a un modello di reazione sequenziale a quattro fasi con quattro costanti di velocità, k1, k2, k3 e k4. Il valore di k3 concordava con quello del tasso di transizione proiettile-calcio (kBF) nell'anello opposto. Inoltre, il valore di 1/k1 + 1/k2 concordato con quello di 1/kFB (kFB, il tasso di transizione da calcio a proiettile nell'anello opposto). Il primo accordo indica che l'idrolisi dell'ATP in ADP-Pi su un anello agisce come un custode del tempo per il rilascio di ADP dall'anello trans opposto, assicurando il rilascio della proteina substrato dall'anello trans prima che venga ricoperto con GroES. Quest'ultimo accordo indica che un evento che si verifica nella seconda fase dopo il legame dell'ATP innesca il rilascio di Pi dall'anello opposto. Credito:Università di Kanazawa
"La struttura calcistica è così abbondante, deve svolgere un ruolo più attivo di quanto pensassimo, " dice l'autore corrispondente Toshio Ando. "Questo meccanismo complesso è importante, perché le chaperonine sono una classe naturale di macchine molecolari. Le sottigliezze di GroEL possono aiutarci a comprendere il ruolo dell'allosteria nelle macchine molecolari più in generale".