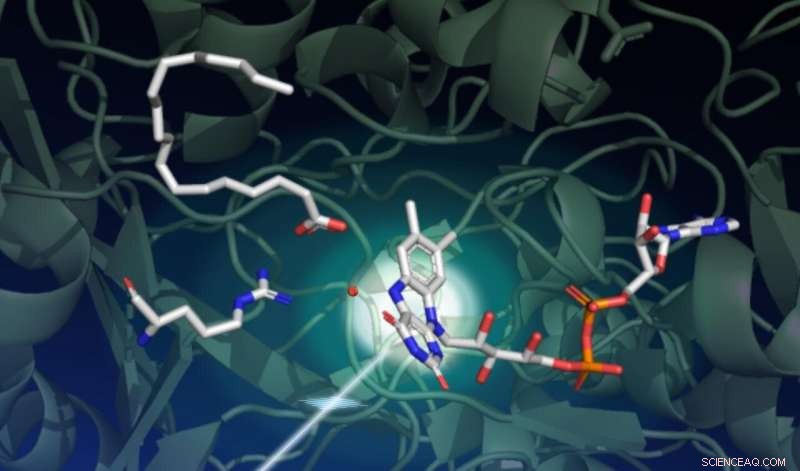
Uno studio che utilizza il laser a raggi X LCLS di SLAC ha catturato il modo in cui la luce guida una serie di complessi cambiamenti strutturali in un enzima chiamato FAP, che catalizza la trasformazione degli acidi grassi in ingredienti di partenza per solventi e combustibili. Questo disegno cattura lo stato iniziale della reazione catalitica. Lo sfondo verde scuro rappresenta l'impalcatura proteica. La parte sensibile alla luce dell'enzima, chiamato il cofattore FAD, è mostrato al centro a destra con i suoi tre anelli che assorbono un fotone proveniente dal basso a sinistra. Un acido grasso in alto a sinistra attende la trasformazione. L'aminoacido mostrato al centro a sinistra svolge un ruolo importante nel ciclo catalitico, e il punto rosso vicino al centro è una molecola d'acqua. Credito:Damien Sorigue/Universite Aix-Marseille
Sebbene molti organismi catturino e rispondano alla luce solare, gli enzimi, le proteine che catalizzano le reazioni biochimiche, sono raramente guidati dalla luce. Finora gli scienziati hanno identificato solo tre tipi di fotoenzimi naturali. Il più nuovo, scoperto nel 2017, è la fotodecarbossilasi degli acidi grassi (FAP). Derivato da alghe microscopiche, utilizza la luce blu per catalizzare la conversione degli acidi grassi, si trova in grassi e oli, in alcani e alcheni.
"Un numero crescente di laboratori prevede di utilizzare i FAP per applicazioni di chimica verde, perché alcani e alcheni sono componenti importanti di solventi e combustibili, compresi benzina e carburanti per aerei. E la trasformazione degli acidi grassi in alcani o alcheni avviene in un unico passaggio all'interno dell'enzima, "dice Martin Weik, il capo di un gruppo di ricerca presso l'Institute of Biologie Structurale presso l'Universite Grenoble Alpes.
Weik è uno dei principali ricercatori di un nuovo studio che ha catturato la complessa sequenza di cambiamenti strutturali che la FAP subisce in risposta alla luce, chiamato fotociclo, che guida questa trasformazione degli acidi grassi. Sebbene i ricercatori abbiano precedentemente proposto un fotociclo FAP, il meccanismo fondamentale non è stato compreso. Gli scienziati non sapevano quanto tempo impiegasse un acido grasso a perdere il suo carbossilato, il gruppo chimico attaccato all'estremità della sua lunga catena di idrocarburi, un passaggio critico nella formazione di alcheni o alcani.
In collaborazione con gli scienziati SLAC, gli esperimenti presso la Linac Coherent Light Source (LCLS) presso il Laboratorio nazionale dell'acceleratore SLAC del Dipartimento dell'energia hanno aiutato a rispondere a molte di queste domande in sospeso. I ricercatori descrivono i loro risultati in Scienza .
Tutti gli strumenti in una cassetta degli attrezzi
Per comprendere un enzima sensibile alla luce come il FAP, gli scienziati utilizzano molte tecniche diverse per studiare i processi che avvengono su un'ampia gamma di scale temporali, poiché l'assorbimento dei fotoni avviene in femtosecondi, o milionesimi di miliardesimo di secondo, mentre le risposte biologiche a livello molecolare avvengono spesso in millesimi di secondo.
"Il nostro internazionale, consorzio interdisciplinare, guidato da Frederic Beisson all'Università di Aix-Marseille, utilizzato una vasta gamma di tecniche, compresa la spettroscopia, cristallografia e approcci computazionali, " Dice Weik. "È la somma di questi diversi risultati che ci ha permesso di avere un primo assaggio di come funziona questo enzima unico in funzione del tempo e nello spazio".
Il consorzio ha prima studiato le complesse fasi del processo catalitico nei propri laboratori domestici utilizzando metodi di spettroscopia ottica, che indagano la struttura elettronica e geometrica degli atomi nei campioni, compreso il legame chimico e la carica. Gli esperimenti spettroscopici hanno identificato gli stati intermedi dell'enzima che accompagnano ogni passaggio, misurarono la loro vita e fornirono informazioni sulla loro natura chimica. Questi risultati hanno motivato la necessità delle capacità ultraveloci di LCLS.
Prossimo, una visione strutturale del processo catalitico è stata fornita dalla cristallografia seriale a femtosecondi (SFX) con il laser a elettroni liberi a raggi X LCLS (XFEL). Durante questi esperimenti, un getto di minuscoli microcristalli FAP è stato colpito con impulsi laser ottici per dare il via alla reazione catalitica, seguito da brevissimo, impulsi a raggi X ultraluminosi per misurare i cambiamenti risultanti nella struttura dell'enzima.
Integrando migliaia di queste misurazioni, acquisite utilizzando vari ritardi temporali tra gli impulsi ottici e a raggi X, i ricercatori sono stati in grado di seguire i cambiamenti strutturali nell'enzima nel tempo. Hanno anche determinato la struttura dello stato di riposo dell'enzima sondando senza il laser ottico.
Sorprendentemente, i ricercatori hanno scoperto che nello stato di riposo, la parte sensibile alla luce dell'enzima, chiamato il cofattore FAD, ha una forma piegata. "Questo cofattore agisce come un'antenna per catturare fotoni. Assorbe la luce blu e avvia il processo catalitico, " Dice Weik. "Pensavamo che il punto di partenza del cofattore FAD fosse planare, quindi questa configurazione piegata era inaspettata."
La forma piegata del cofattore FAD è stata effettivamente scoperta per la prima volta dalla cristallografia a raggi X presso l'European Synchrotron Radiation Facility, ma gli scienziati sospettavano che questa curva fosse un artefatto del danno da radiazioni, un problema comune per i dati cristallografici raccolti da sorgenti di luce di sincrotrone. Solo gli esperimenti SFX potrebbero confermare questa configurazione insolita a causa della loro capacità unica di acquisire informazioni strutturali prima di danneggiare il campione, dice Weik.
"Questi esperimenti sono stati integrati da calcoli, " Aggiunge, "Senza i calcoli quantistici di alto livello eseguiti da Tatiana Domratcheva dell'Università statale di Mosca, non avremmo capito i nostri risultati sperimentali."
Prossimi passi
Nonostante la migliore comprensione del fotociclo di FAP, restano le domande senza risposta. Per esempio, i ricercatori sanno che l'anidride carbonica si forma durante una certa fase del processo catalitico in un momento e in un luogo specifici, ma non conoscono il suo stato in quanto lascia l'enzima.
"Nel futuro lavoro XFEL, vogliamo identificare la natura dei prodotti e fotografare il processo con un passo molto più piccolo in modo da risolvere il processo in modo molto più dettagliato, " dice Weik. "Questo è importante per la ricerca fondamentale, ma può anche aiutare gli scienziati a modificare l'enzima per svolgere un compito per un'applicazione specifica".