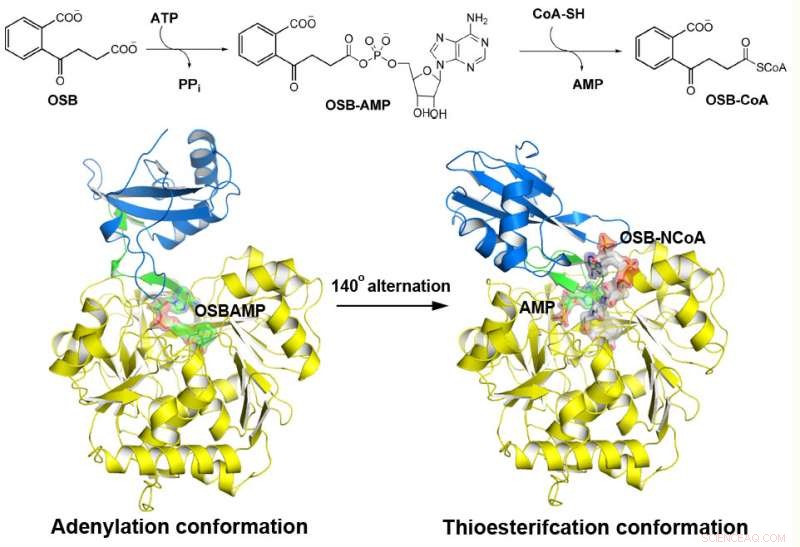
MenE catalizza una reazione in due fasi in due diverse strutture. Credito:Dipartimento di Chimica, HKUST
L'o-Succinilbenzoil-CoA (OSB-CoA) sintetasi (MenE) è un enzima essenziale nella biosintesi batterica della vitamina K e un obiettivo importante nello sviluppo di nuovi antibiotici. È un membro della famiglia degli enzimi adenilanti (ANL), che riconfigurano il loro sito attivo in due diverse conformazioni attive, uno per la semireazione di adenilazione e l'altro per una semireazione di tioesterificazione, in un meccanismo catalitico di alternanza di domini. Sebbene siano stati recentemente scoperti diversi aspetti del meccanismo di adenilazione in MenE, la sua conformazione di tioesterificazione rimane sfuggente.
Utilizzando una proteina mutante Bacillus subtilis cataliticamente competente complessata con un analogo OSB-CoA, i ricercatori della Hong Kong University of Science and Technology hanno rivelato un sito attivo di tioesterificazione specificamente conservato tra gli ortologhi MenE e una modalità di legame al substrato distinta da quelle di molte altre sintetasi acil/aril-CoA. Sono stati identificati diversi residui che contribuiscono specificamente alla semireazione di tioesterificazione senza influenzare la semireazione di adenilazione, e hanno anche osservato un movimento sostanziale del gruppo succinilico attivato nella semireazione di tioesterificazione.
I loro risultati sono stati pubblicati nel Journal of Biological Chemistry il 21 luglio, 2017.
"I nostri risultati forniscono nuove informazioni sulla catalisi dell'alternanza di domini di un enzima batterico essenziale per la biosintesi della vitamina K, e dei suoi omologhi adenilanti nella famiglia degli enzimi ANL, " disse Zhihong Guo, professore associato presso il Dipartimento di Chimica dell'HKUST. "Il nostro lavoro ha convalidato l'ipotesi che una modalità di legame del substrato distinta sia unica per questo enzima".
MenE catalizza una reazione in due fasi in due diverse strutture. Credito:Dipartimento di Chimica, HKUST
Come membro della famiglia di enzimi ANL, L'OSB-CoA sintetasi (MenE) è un prezioso bersaglio farmacologico nella via biosintetica della vitamina K, ma si sa ancora poco sulla struttura dell'enzima.
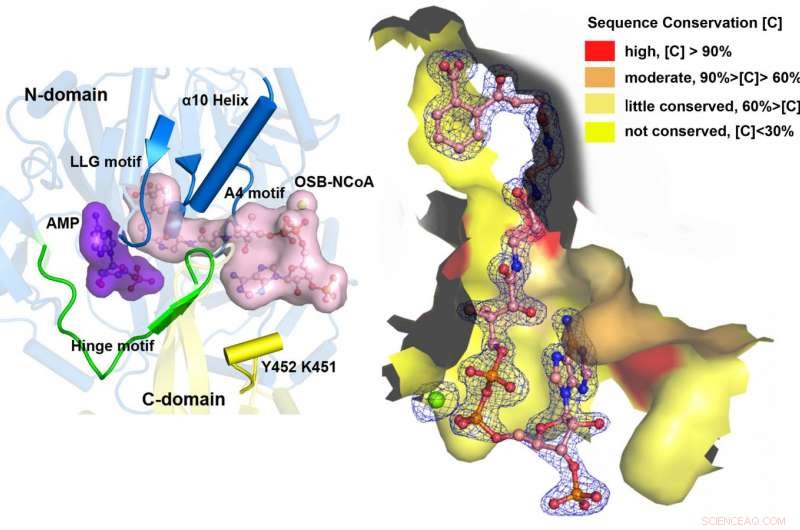
"Abbiamo costruito strutture cristalline ad alta risoluzione di un doppio mutante cataliticamente competente (IRAK) di bsMenE in complesso con un analogo del prodotto stabile, OSB-NCoA, e una combinazione di OSB-NCoA e AMP, " disse Guo. "Inoltre, queste strutture cristalline hanno rivelato i residui di amminoacidi che contribuiscono al riconoscimento e al legame dei substrati e dei prodotti nella reazione di tioesterificazione. Questi risultati non solo hanno fornito un supporto inequivocabile per il meccanismo catalitico di alternanza di domini degli enzimi ANL in generale; hanno anche rivelato l'esclusivo sito attivo di tioesterificazione delle sintetasi OSB-CoA e hanno fornito la base strutturale per la loro catalisi della reazione di tioesterificazione per facilitare la loro utilità come bersaglio di farmaci".
"I nostri risultati forniscono nuove informazioni sul meccanismo di alternanza dei domini dell'enzima biosintetico essenziale della vitamina K e dei suoi omologhi nella famiglia degli enzimi ANL, e ci aiuterà a costruire un ciclo catalitico proteico in maniera continua, cosa che nessuno ha mai fatto prima".