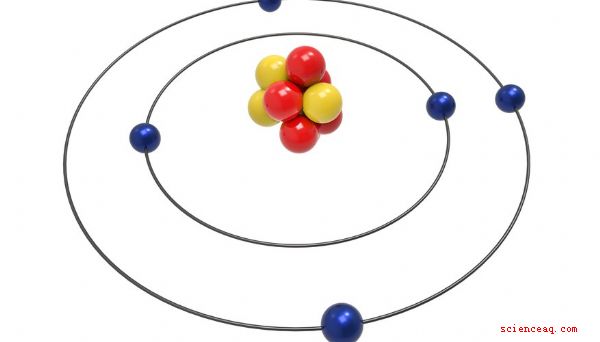
Gli atomi costituiscono tutta la materia. Tutto con massa e volume, grande o piccolo, contiene atomi. Abbastanza sorprendentemente, i piccoli atomi contengono particelle ancora più piccole. Protoni, neutroni ed elettroni sono i tre componenti principali di tutti gli atomi. Il numero e la disposizione di queste tre particelle inimmaginabilmente piccole determina le proprietà e il comportamento degli atomi che li contengono.
TL; DR (troppo lungo; non letto)
Per trovare il numero di neutroni in un isotopo, sottrarre il numero di protoni dalla massa atomica dell'isotopo. Il numero atomico dell'elemento è uguale al numero di protoni. Il calcolo del numero di neutroni diventa quindi la massa atomica dell'isotopo meno il numero atomico dell'elemento è uguale al numero di neutroni. Per l'uranio-235, numero atomico 92, il numero di neutroni è 235-92 \u003d 143 o 143 neutroni.
Particelle negli atomi
Quasi tutti gli atomi contengono tre particelle principali: protoni, neutroni ed elettroni. Protoni e neutroni formano il nucleo, o il centro, dell'atomo. Gli elettroni, molto più piccoli dei protoni e dei neutroni, circondano il nucleo, sfrecciando alla velocità della luce. I protoni hanno una carica positiva, i neutroni non hanno carica e gli elettroni hanno una carica negativa. In un atomo neutro, il numero di protoni è uguale al numero di elettroni, ma il numero di neutroni non è sempre uguale al numero di protoni.
Identificazione degli atomi
Il numero di protoni in un atomo determina quale tipo di elemento che forma l'atomo. L'idrogeno, primo elemento nella tavola periodica, ha un solo protone. L'elio, secondo nella tavola periodica, ha due protoni. L'oro, numero 79 nella tavola periodica, ha 79 protoni. La tavola periodica degli elementi mostra gli elementi in ordine di numero di protoni negli atomi.
Isotopi degli atomi
Un isotopo di un elemento significa atomi con lo stesso numero atomico ma numeri di massa diversi. Quindi, gli isotopi di un elemento hanno un numero diverso di neutroni. L'idrogeno ha tre isotopi. L'idrogeno, la forma più comune dell'atomo, ha un protone e un elettrone. Il deuterio, un isotopo di idrogeno, ha ancora solo un protone e un elettrone, ma ha anche un neutrone. Il trizio, un altro isotopo dell'idrogeno, ha ancora solo un protone e un elettrone ma ha due neutroni.
Calcolo dei neutroni
La massa di un atomo è costituita dalle masse combinate di protoni e neutroni. La massa degli elettroni è trascurabile nella massa complessiva dell'atomo. I protoni misurano circa un'unità di massa atomica e i neutroni misurano solo leggermente più di un'unità di massa atomica. Per trovare il numero di neutroni nell'atomo, sottrarre il numero atomico dalla massa atomica.
Il numero atomico e la massa atomica media possono essere trovati nella tavola periodica. Tuttavia, la massa di diversi isotopi viene spesso scritta come parte del nome dell'isotopo. Uranio-235 significa che l'elemento uranio, numero atomico 92, ha 92 protoni e una massa atomica di 235. D'altra parte, l'uranio-238 ha una massa di 238 ma ha ancora solo 92 protoni. Un metodo alternativo per scrivere un isotopo mostra la massa atomica come apice e il numero atomico come pedice. L'uranio-235 potrebbe anche essere scritto come 235 92 U dove U è l'abbreviazione standard per l'uranio. Usando gli isotopi di idrogeno come esempi, l'atomo "normale" di idrogeno ha una massa atomica di 1 e il numero atomico è 1, il che significa che l'atomo ha un solo protone. Usando la formula, la massa atomica di 1 meno il numero atomico, o il numero di protoni, di 1 fornisce l'equazione 1-1 \u003d 0, quindi l'atomo di idrogeno ha 0 neutroni. D'altra parte, il trizio, un isotopo di idrogeno, ha una massa atomica di 3 ma il numero atomico di idrogeno rimane 1 perché l'atomo ha un solo protone. Usando l'equazione, la massa atomica meno il numero atomico è uguale al numero di neutroni, dà 3-1 \u003d 2, quindi il trizio ha 2 neutroni. Un altro elemento comune, il carbonio, ha anche diversi isotopi. L'atomo di carbonio normale, il numero atomico 6, ha una massa atomica di 12. Usando la formula, la massa atomica meno il numero atomico è uguale al numero di neutroni, mostra 12-6 \u003d 6, quindi l'atomo di carbonio 12 ha 6 neutroni. Il carbonio-14, usato per la datazione dell'età radioattiva di fossili con meno di 10.000 anni, ha ancora 6 protoni ma ha una massa atomica di 14. Il calcolo del numero di neutroni utilizza la stessa formula, quindi 14-6 \u003d 8, quindi il carbonio-14 ha 8 neutroni nel suo nucleo.