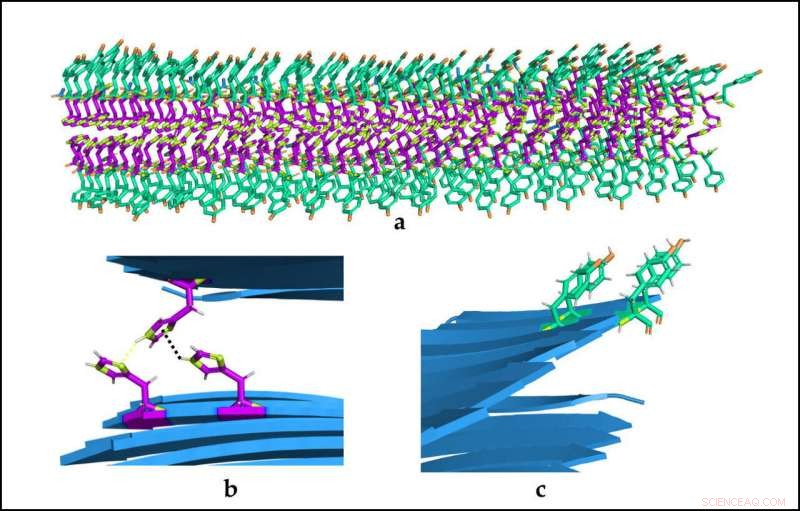
(A) Organizzazione spaziale delle biostrutture catalitiche. (B) e (C) Dettaglio dei due tipi di amminoacidi e delle loro interazioni. Credito:Universitat Autònoma de Barcelona
I ricercatori dell'UAB hanno progettato biostrutture minimaliste che imitano gli enzimi naturali, in grado di svolgere due attività differenziate e reversibilmente regolate grazie ad una combinazione unica di proprietà strutturali e funzionali. La strategia utilizzata apre le porte alla creazione di nanomateriali "intelligenti" con combinazioni su misura di funzioni catalitiche.
C'è un crescente interesse per i sistemi sintetici in grado di eseguire reazioni chimiche bioispirate senza richiedere le strutture complesse che caratterizzano gli enzimi nei loro componenti. Uno degli approcci più esplorati è l'autoassemblaggio di peptidi, molecole più piccole delle proteine, a causa della loro biocompatibilità e del modo in cui le loro proprietà strutturali e funzionali possono essere controllate.
I ricercatori dell'Istituto di biotecnologia e biomedicina dell'Universitat Autònoma de Barcelona (IBB-UAB) hanno recentemente progettato una delle più piccole strutture enzimatiche mimetiche mai esistite. Questi peptidi sono costituiti da sette a nove amminoacidi che si autoassemblano spontaneamente per formare fibre amiloidi stabili e idrogeli solidi, innocuo per le cellule.
I peptidi si formano con solo due tipi di amminoacidi idrosolubili (tirosina e istidina), un codice binario contenente tutte le informazioni necessarie per formare nanostrutture. Inoltre, sono reversibili e possono svolgere due attività catalitiche differenziate e non correlate.
I ricercatori sono riusciti a creare un sistema più semplice e in grado di controllare meglio l'attività enzimatica, e per la prima volta, una struttura in cui gli stessi amminoacidi che forniscono attività catalitica contribuiscono anche a modellare l'architettura macromolecolare. Negli studi precedenti, queste capacità erano segregate in diverse regioni della molecola, che ha portato a peptidi più lunghi e/o peptidi con una singola funzione.
"Il quid della questione è che l'attività catalitica di fibre e idrogel può essere raggiunta solo quando i peptidi si autoassemblano, " spiega Salvador Ventura, coordinatore dello studio. "La strategia che abbiamo utilizzato pone le basi per la creazione di materiali di nanostrutture "intelligenti", con combinazioni su misura di funzioni catalitiche per una serie di applicazioni pratiche."
Proprietà uniche
Fino ad ora, la maggior parte dei peptidi minimalisti progettati mancava di una delle capacità più importanti degli enzimi naturali:la capacità di regolare in modo reversibile la loro attività. In questo studio, i ricercatori sono riusciti a controllare la capacità di assemblaggio, e questo permette di alternare forme attive e inattive con semplici variazioni di pH.
Inoltre, i nuovi peptidi hanno proprietà che gli enzimi naturali non hanno, poiché questi svolgono solo attività catalitiche. Ora, i peptidi incorporano due diversi tipi di attività (idrolitica ed elettrocatalitica) che possono essere condotte simultaneamente o alternativamente. In ogni altro caso, ciò richiederebbe due enzimi artificiali strutturalmente diversi che sarebbero centinaia di volte più grandi e più costosi.
Un'altra caratteristica di questi nuovi enzimi artificiali che i ricercatori sottolineano è la spontaneità dell'autoassemblaggio, il che implica che non sono necessari reagenti chimici aggiuntivi o l'applicazione di calore, che potrebbe rivelarsi tossico o avere effetti drastici sulla sua struttura.
Maggiore efficienza ed economia
Gli idrogel e le fibre simili all'amiloide consentono di generare microreattori solidi e più efficienti ed economici, in cui il prodotto finale della reazione può essere facilmente separato dall'enzima artificiale.
"Le strutture macromolecolari che siamo riusciti a creare potrebbero avere importanti applicazioni nella microfluidica, e anche nella somministrazione di farmaci, poiché possono incapsulare il farmaco nel suo stato assemblato e liberarlo in modo specifico, una volta ottenuto il contesto di cella corretto, semplicemente smontando, "Salvador Ventura mette in evidenza.
Salvador Ventura è a capo del gruppo Protein Folding and Conformational Diseases presso l'IBB. "Abbiamo iniziato le linee di ricerca nanotecnologiche solo tre anni fa, ma la nostra conoscenza sul meccanismo molecolare dell'assemblaggio delle proteine nelle strutture amiloidi ci ha aiutato a sviluppare nuove funzioni, nanomateriali sintetici con proprietà che non possono essere ottenute con peptidi o proteine naturali, " lui dice.