Il parassita unicellulare Cryptosporidium è una delle principali cause di malattie diarroiche mortali nei bambini piccoli e una recente epidemia nel Regno Unito evidenzia quanto sia vulnerabile l'approvvigionamento idrico a questo agente patogeno.
Non esistono farmaci o vaccini efficaci, il che rende questo organismo importante da studiare. Il parassita infetta le cellule che rivestono l'intestino e si impegna nella replicazione sia asessuata che sessuale, che i ricercatori sospettano siano entrambe fondamentali per l'infezione e la trasmissione prolungate.
Ma il meccanismo attraverso il quale il parassita diventa maschio o femmina è sconosciuto. "Questi parassiti non hanno cromosomi sessuali, come l'X o l'Y umani", afferma Katelyn A. Walzer, ricercatrice post-dottorato presso lo Striepen Lab della Penn's School of Veterinary Medicine. "Rivelare il modo in cui scelgono il sesso è di fondamentale interesse biologico e fornisce un nuovo obiettivo chiave per bloccare la trasmissione e l'infezione."
Walzer è l'autore principale di uno studio, pubblicato su Nature , che rivela il programma di espressione genetica dell'intero ciclo di vita del Cryptosporidium.
Utilizzando il sequenziamento dell'RNA, i ricercatori hanno profilato più di 9.000 parassiti, provenienti da colture cellulari e topi infetti, e hanno sviluppato l'atlante unicellulare di Cryptosporidium, che rivela quali geni sono espressi e in quali punti del ciclo di vita.
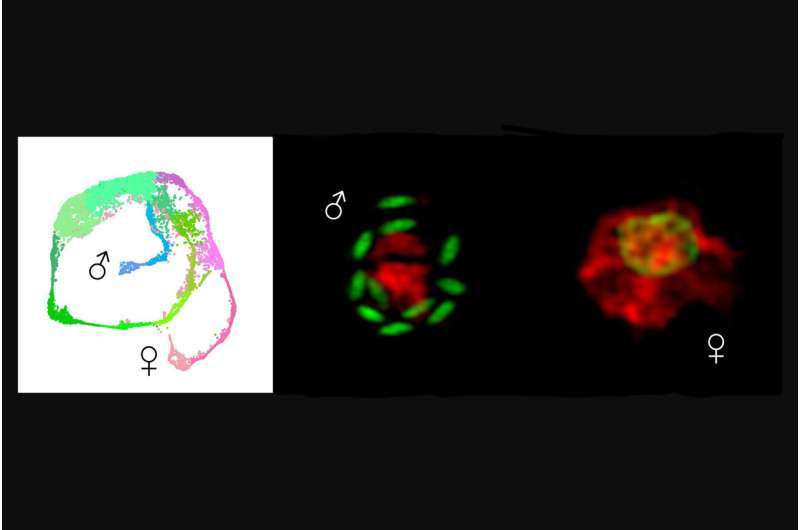
In una seconda importante scoperta, i ricercatori hanno identificato il primo determinante della mascolinità, un gene chiamato Myb-M.
"In questo e in altri lavori mostriamo che la parte sessuale di questo ciclo di vita è fondamentale per l'infezione e bloccarla attraverso la contraccezione antiparassitaria bloccherà l'infezione", afferma l'autore senior Boris Striepen. Dice che interrompendo il sesso "potremmo essere in grado di curare la malattia o indebolire il parassita per progettare un vaccino, quindi penso che ci sia un potenziale di traduzione davvero forte."
Ciò si basa su ricerche precedenti che hanno rivisto il ciclo di vita in uno con solo tre fasi:un'unica forma asessuata, maschi e femmine, mentre la letteratura prevalente proponeva una fase aggiuntiva intermedia.
Walzer spiega che il Cryptosporidium infetta le persone, spesso attraverso l'acqua contaminata, in una forma simile a una spora chiamata oocisti, che è resistente alla clorazione dell'acqua. Una volta nell'intestino, i parassiti emergono dalle spore per invadere le cellule epiteliali che rivestono l'intestino e si replicano all'interno di quelle cellule prima di andarsene e invadere nuove cellule intestinali.
Questo ciclo asessuato di invasione, replicazione ed uscita avviene tre volte prima che i parassiti si differenziano in gameti maschili e femminili, e poi la fecondazione porta a nuove oocisti.
Walzer afferma che, attraverso questa nuova ricerca, "abbiamo una comprensione completa di tutti i geni coinvolti in ciascuno di questi processi, dall'invasione alla crescita, alla divisione per poi formare nuovamente la forma invasiva".
Dice che questo atlante offre un progetto dettagliato di ogni aspetto della biologia del parassita e delle sue potenziali vulnerabilità. Il Cryptosporidium produce molte proteine necessarie per invadere e manipolare l'ospite e il lavoro del team analizza queste diverse proteine in base ai tempi con cui vengono letti i loro geni.
"Le forme invasive del parassita sono dotate di una serie di armi che consentono loro di invadere e superare le nostre cellule, e questo arsenale è assemblato con notevole precisione temporale", afferma Striepen. Lo paragona alla catena di montaggio di una fabbrica di automobili in cui i nuovi componenti vengono realizzati appena in tempo e Walzer ha sviluppato un elenco di tutte le parti e di quando vengono assemblate.
Walzer afferma che i ricercatori in questo campo sono entusiasti dell'atlante unicellulare del Cryptosporidium perché possono cercare il contesto in cui sono espressi i geni che stanno studiando. Si tratta di informazioni molto utili per chi cerca obiettivi di farmaci e vaccini, poiché aiuta a prevedere le fasi dell'infezione in cui il parassita potrebbe essere più vulnerabile.
Progettando parassiti per esprimere la fluorescenza, i ricercatori sono arrivati anche alla seconda scoperta chiave:la scoperta del fattore di trascrizione, ovvero una proteina che regola l'espressione genetica, responsabile della mascolinità, Myb-M.
"Quando abbiamo forzato il parassita a produrre questo fattore in qualsiasi momento, ogni singolo parassita è diventato maschio, e quando lo abbiamo portato via nessun maschio si è sviluppato. È importante sottolineare che entrambe queste manipolazioni hanno bloccato l'infezione", afferma Walzer.
Striepen afferma che questa scoperta sottolinea il valore del sesso parassitario come obiettivo di intervento, e Walzer afferma che questo studio "ci porta anche a conoscere il catalogo completo dei geni richiesti per il sesso parassitario, fornendo importanti indizi sul meccanismo e sugli obiettivi traslazionali". P>
Walzer afferma che nella ricerca futura è interessata a approfondire il modo in cui Myb-M guida il destino maschile e a comprendere più in generale come la regolazione della trascrizione guida le differenze specifiche dello stadio per orchestrare il complesso ciclo di vita.
Ulteriori informazioni: Katelyn A. Walzer et al, Controllo trascrizionale del ciclo di vita del Cryptosporidium, Natura (2024). DOI:10.1038/s41586-024-07466-1
Informazioni sul giornale: Natura
Fornito dall'Università della Pennsylvania