I sistemi CRISPR-Cas hanno rivoluzionato la biotecnologia offrendo modi per modificare i geni come un paio di forbici programmabili. In natura, i batteri utilizzano questi sistemi per combattere virus mortali. Una recente collaborazione internazionale guidata dall’Università di Copenaghen ha fatto luce sui sistemi CRISPR-Cas più enigmatici; il sistema di tipo IV. Anche se questi sistemi atipici non tagliano i geni, le loro funzioni uniche si dimostrano promettenti nella nostra lotta contro la resistenza agli antibiotici.
I sistemi CRISPR-Cas sono sistemi immunitari adattivi batterici che prendono di mira e tagliano gli acidi nucleici (DNA/RNA) di parassiti genetici invasori come i batteriofagi (fagi); virus che infettano – e alla fine uccidono – le cellule batteriche. Sono costituiti da due componenti principali; l'array CRISPR, che immagazzina la memoria immunitaria delle infezioni virali passate, e i geni cas (che codificano per le proteine Cas), responsabili del coordinamento delle diverse fasi della risposta immunitaria.
Attualmente esistono sei tipi noti di sistemi CRISPR-Cas, classificati in base alla loro composizione proteica. Tutti i tipi, eccetto il tipo IV, includono nucleasi per la scissione del DNA/RNA.
I sistemi CRISPR-Cas hanno guadagnato popolarità come strumenti di editing genetico, consentendo tagli programmabili precisi in posizioni genomiche specifiche, portando infine all'assegnazione del Premio Nobel per la chimica 2020 per lo sviluppo di questa tecnologia.
"I sistemi di tipo IV sono gli strani cugini tra i sistemi CRISPR-Cas, poiché mancano del modulo di acquisizione della memoria immunitaria e del componente per il taglio del DNA che hanno reso i sistemi CRISPR-Cas così famosi. Queste caratteristiche, e la loro stretta associazione con molecole circolari mobili di DNA, chiamati plasmidi, ci hanno motivato ad assumerci il compito di risolvere il loro ruolo intrigante e le funzioni molecolari sottostanti," spiega Fabienne Benz, postdoc dell'Università di Copenaghen e co-prima autrice di uno studio su questo argomento pubblicato su Cell Host &Microbe .
Poiché la caratteristica distintiva di CRISPR-Cas è la capacità di tagliare il DNA in siti specifici, i sistemi di Tipo IV operano in un modo completamente diverso. Sono privi delle tipiche "forbici" della nucleasi, ma ospitano invece un'elicasi DinG, una misteriosa proteina che svolge il DNA.
"Il punto di svolta in questa indagine è arrivato quando ci siamo resi conto che i sistemi di tipo IV non tagliano il DNA. Abbiamo invece scoperto che silenziano l'espressione genetica nelle posizioni target. Si tratta di una funzionalità unica che potrebbe avere importanti applicazioni biotecnologiche", afferma Rafael Pinilla. -Redondo, Professore assistente presso il Dipartimento di Biologia e principale coordinatore della ricerca.
I ricercatori hanno raggiunto un'altra svolta quando hanno scoperto come questi sistemi possono funzionare senza i componenti necessari per creare la memoria immunitaria.
"I sistemi di tipo IV possono bypassare la mancanza di un modulo di acquisizione della memoria dirottando moduli compatibili da altri sistemi CRISPR-Cas presenti nel batterio ospite. Ciò è affascinante perché questi altri sistemi sono solo lontanamente correlati", spiega Sarah Camara-Wilpert, co- primo autore di questo studio.
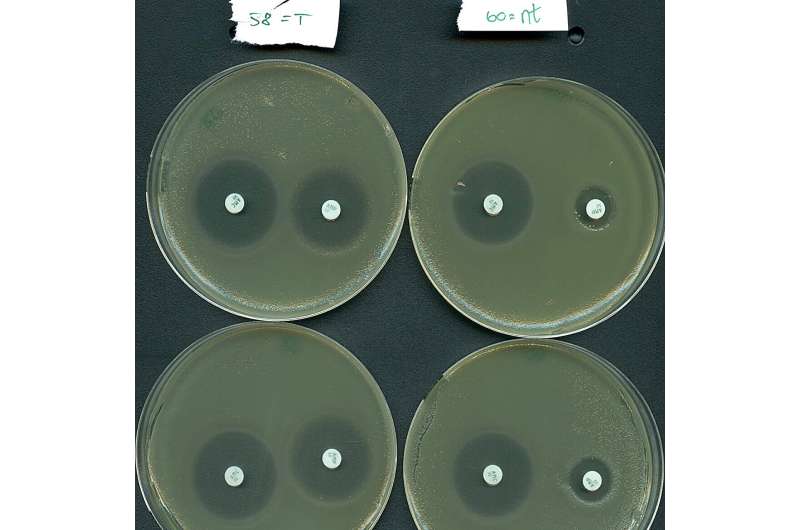
Ma di cosa si tratta? Ebbene, si scopre che i sistemi di Tipo IV hanno una marcata tendenza a prendere di mira naturalmente i plasmidi, piuttosto che i virus batterici. È importante sottolineare che i plasmidi presi di mira spesso ospitano più geni di resistenza agli antibiotici come quelli trovati nei superbatteri ospedalieri. Si stima che la resistenza antimicrobica sia direttamente responsabile di oltre 1 milione di decessi ogni anno dovuti al fallimento del trattamento.
Ispirati dalla loro naturale funzione di targeting dei plasmidi, i team di ricerca hanno riprogrammato efficacemente un sistema di tipo IV per silenziare selettivamente i geni di resistenza trasportati da un batterio ad alto rischio nei pazienti ospedalizzati.
"I nostri risultati indicano che i sistemi di Tipo IV hanno un potenziale come nuovo mezzo per combattere la resistenza agli antibiotici, poiché siamo stati in grado di risensibilizzare un importante agente patogeno al trattamento antibiotico", afferma il professor Søren Sørensen, co-ultimo autore dello studio.
Questo studio è stato un importante sforzo interdisciplinare che ha coinvolto sette gruppi di ricerca internazionali provenienti da vari paesi. Sebbene il progetto fosse iniziato come una collaborazione tra soli due gruppi, ha gradualmente acquisito slancio, attirando partner con competenze diverse.
"Abbiamo sperimentato un meraviglioso effetto valanga, in cui ogni nuovo partner ha amplificato l'impatto del lavoro condividendo le proprie competenze uniche e fornendo spunti cruciali per risolvere i misteri che circondano i sistemi di tipo IV. È stato un tour de force collaborativo, esattamente come la scienza dovrebbe essere", nota Pinilla-Redondo.
Ulteriori informazioni: Fabienne Benz et al, I sistemi CRISPR-Cas di tipo IV-A3 guidano i conflitti interplasmidici acquisendo spaziatori in trans, Ospite cellulare e microbi (2024). DOI:10.1016/j.chom.2024.04.016
Informazioni sul giornale: Ospite cellulare e microbi
Fornito dall'Università di Copenaghen