Credito:Zhang et al.
(Phys.org)—Le lezioni di chimica di livello iniziale imparano a conoscere gli acidi di Brønsted-Lowry. Questi acidi si dissociano in acqua per formare un H + ione e un controione caricato negativamente. Anche se questa è una lezione fondamentale, l'effettivo meccanismo di dissoluzione è un po' un mistero. l'H + la molecola si combina con l'acqua per formare H 3 oh + , ma il numero di molecole d'acqua necessarie per idratare l'acido più semplice, HF, è sconosciuto. Tentativi di isolare HF e H 2 Oh sono difficili, in gran parte a causa dell'elevata reattività dell'HF e della tendenza dell'acqua a formare legami idrogeno.
Per comprendere il meccanismo fondamentale alla base della dissoluzione dell'acido, Zhang et al. dall'Istituto per la ricerca chimica dell'Università di Kyoto HF incapsulato, così come HF•H 2 O e H 2 O all'interno di un C 70 fullerene. Hanno scoperto che per forzare le molecole nella cavità aperta del fullerene, le molecole necessarie "spingendo dall'esterno" utilizzando condizioni di alta pressione, e "tirando dall'interno" tramite interazioni molecolari tra HF e H 2 O. Sono stati in grado di identificare come si è verificato il legame idrogeno tra queste due molecole. Il loro lavoro appare in Progressi scientifici .
Il lavoro precedente di Zhang et al. ha mostrato che il C 70 fullerene potrebbe essere aperto in un processo in tre fasi che prevedeva l'aggiunta di un derivato della piridazina ai legami alfa o beta sul C 70 . Questo ha creato un'apertura ad anello di 13 membri che ha formato composti leggermente diversi, indicato con α-13mem e β-13mem. La disidratazione di entrambi i composti ha provocato un'apertura dell'anello di 16 membri. L'anello potrebbe essere richiuso tramite idrolisi e un processo in due fasi.
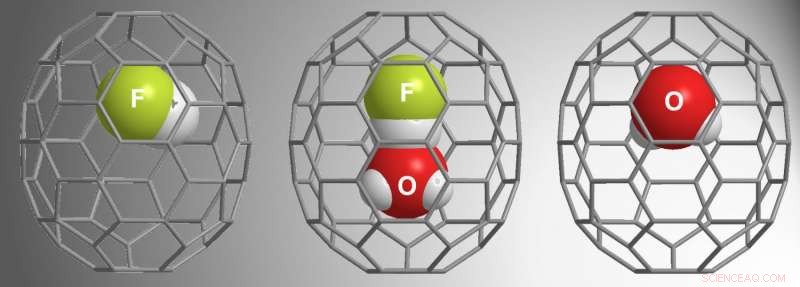
β-16mem era abbastanza grande da catturare H 2 Oh, ma α-16mem non lo era. Dati questi risultati di studi precedenti, per lo studio in corso, Zhang et al. usato α-16mem per cercare di incapsulare HF. Anziché, hanno trovato tre diverse possibilità all'interno dei fullereni:HF@C 70 , (HF•H 2 O)@C 70 , e H 2 O@C 70 .
Le loro condizioni di reazione richiedevano un'alta pressione (9000 atm) per "spingere" la molecola ospite nella cavità α-16mem. Studi dipendenti dal tempo hanno mostrato che l'HF riempiva prima la cavità, seguito da H 2 O•HF, e poi H 2 O. In particolare, la gabbia aperta non ha intrappolato H 2 O quando l'HF non era presente, indicando che l'interazione tra H 2 O e HF hanno richiesto H 2 O incapsulamento. Ulteriori studi hanno dimostrato che l'HF "tira" H 2 O nella cavità mentre l'ambiente ad alta pressione lo "spinge" nella cavità.
Questo processo ha permesso agli autori di studiare l'interazione tra H 2 O e HF in un ambiente confinato utilizzando 1 HNMR. L'analisi NMR ha mostrato che la (H 2 O•HF)@C 70 è stato spostato verso il basso da H 2 O@C 70 e HF@C 70 , che indicava il legame idrogeno. Per di più, i valori di spostamento e accoppiamento indicavano che l'ossigeno agiva come accettore del legame idrogeno.
Utilizzando la diffrazione di raggi X da cristallo singolo, Zhang et al. dimostrato la struttura del (HF•H 2 O)@C 70 , e riporta la prima struttura a raggi X per C . doppiamente incapsulato 70 . Queste analisi e studi sperimentali hanno confermato che l'H + lo ione in HF forma un legame idrogeno lineare con l'O in H 2 O. Inoltre, rispetto ai calcoli teorici di H . libero 2 O e HF, gli studi delle molecole incapsulate hanno rivelato uno stretto contatto con idrogeno e ossigeno che può essere caratteristico di H3O + •F - .
il C 70 il derivato del fullerene fornisce un eccellente nanoambiente per lo studio di specie chimiche isolate, qualcosa che non era disponibile per i chimici in passato. Questo ambiente isolato ha permesso agli autori di studiare le interazioni di due composti senza interferenze dall'ambiente circostante e ha fornito importanti informazioni su un processo chimico onnipresente.
© 2017 Phys.org